Zn + HNO3 loãng → Zn(NO3)2 + N2O + H2O | Zn + HNO3 ra N2O
Phản ứng Zn + HNO3 loãng ra N2O thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Zn có lời giải, mời các bạn đón xem:
4Zn + 10HNO3 loãng → 4Zn(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
1. Phương trình phản ứng Zn tác dụng với HNO3 ra N2O
4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
2. Điều kiện phản ứng giữa Zn với HNO3 ra N2O
- Phản ứng diễn ra ở ngay điều kiện thường.
- HNO3 loãng.
3. Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa – khử:
Chất khử: Zn; chất oxi hóa: HNO3.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
- Quá trình oxi hóa:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa
Bước 4: Điền hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
3. Mở rộng kiến thức về kẽm (Zn)
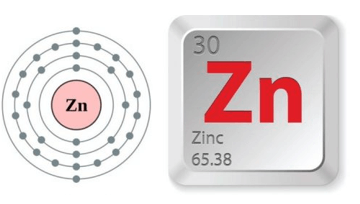
3.1. Vị trí trong bảng tuần hoàn
- Kẽm ở ô số 30, thuộc chu kì 4, nhóm IIB của bảng tuần hoàn.
- Trong các hợp chất, kẽm có số oxi hóa là +2.
3.2. Tính chất
- Zn là kim loại có màu lam nhạt. Trong không khí ẩm, kẽm bị phủ một lớp oxit mỏng nên
có màu xám.
- Kẽm là kim loại có khối lượng riêng lớn (D = 7,13g/cm3), có tonc = 419,5oC.
- Ở điều kiện thường, Zn khá giòn nên không kéo dài được, nhưng khi đun nóng từ 100 -
150oC lại dẻo và dai, đến 200oC thì giòn trở lại và có thể tán được thành bột.
- Zn ở trạng thái rắn và các hợp chất của kẽm không độc. Riêng hơi của ZnO thì rất độc.
- Zn là một kim loại khá hoạt động, có tính khử mạnh hơn sắt. Phản ứng với nhiều phi kim như O2, Cl2, S, ... và các dung dịch axit, kiềm, muối. Ví dụ:
Zn + S ZnS
Zn + 2HCl → ZnCl2 + H2
Zn + CuSO4 → ZnSO4 + Cu
3.3. Ứng dụng
- Mạ (hoặc tráng) để bảo vệ bề mặt các dụng cụ, thiết bị bằng sắt, thép để chống gỉ, chống ăn mòn.
- Chế tạo hợp kim như hợp kim với Cu - Zn.
- Chế tạo pin điện hóa, phổ biến nhất là pin Zn - Mn ... .
- Một số hợp chất của Zn dùng trong y học, chẳng hạn như ZnO dùng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,...
4. Mở rộng kiến thức về HNO3
4.1. HNO3 có tính axit
HNO3 là một trong các axit mạnh nhất, trong dung dịch loãng phân li hoàn toàn thành ion H+ và NO3-.
HNO3 mang đầy đủ các tính chất của 1 axit như: làm quỳ tím hóa đỏ, tác dụng bazơ, basic oxide và muối của axit yếu hơn tạo thành muối nitrate. Ví dụ:
MgO + 2HNO3 → Mg(NO3)2 + H2O
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
BaCO3 + 2HNO3 → Ba(NO3)2 + CO2 + H2O
4.2. HNO3 có tính oxi hóa mạnh:
Nitric acid là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử, mà HNO3 có thể bị khử đến các sản phẩm khác nhau của nitơ.
a. Tác dụng với kim loại:
+ HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrate, H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3).
+ Thông thường: HNO3 loãng → NO, HNO3 đặc → NO2 .
+ Với các kim loại có tính khử mạnh: Mg, Al, Zn,… HNO3 loãng có thể bị khử đến N2O, N2, NH4NO3.
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
4Zn + 10HNO3 loãng → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Chú ý: Fe, Al, Cr bị thụ động trong dd HNO3 đặc, nguội do tạo màng oxit bền, bảo vệ kim loại khỏi tác dụng của axit, do đó có thể dùng bình Al hoặc Fe để đựng HNO3 đặc, nguội.
b. Tác dụng với phi kim:
HNO3 có thể oxi hoá được nhiều phi kim, như:
S + 6HNO3 H2SO4 + 6NO2 + 2H2O
C + 4HNO3 CO2 + 4NO2 + 2H2O
5HNO3 + P H3PO4 + 5NO2 + H2O
c. Tác dụng với hợp chất:
HNO3 đặc còn oxi hóa được hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
4HNO3 + FeO → Fe(NO3)3 + NO2 + 2H2O
4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
5. Bài tập vận dụng liên quan đến Zn và HNO3
Câu 1: Dãy gồm các chất không bị hòa tan trong dung dịch HNO3 đặc nguội là
A. Al, Zn, Cu
B. Al, Cr, Fe
C. Zn, Cu, Fe
D. Al, Fe, Mg
Hướng dẫn giải
Đáp án B
Các kim loại Al, Cr, Fe bị thụ động hóa trong H2SO4 và HNO3 đặc, nguội do tạo trên bề mặt kim loại một lớp màng oxit đặc biệt, bền với axit và ngăn cản hoặc ngừng hẳn sự tiếp diễn của phản ứng.
Câu 2: Khi làm thí nghiệm với dung dịch HNO3 đặc thường sinh ra khí nitơ đioxit gây ô nhiễm không khí. Công thức của nitơ đioxit là
A. NH3.
B. NO.
C. NO2.
D. N2O.
Hướng dẫn giải:
Đáp án C
Công thức của nitơ đioxit là NO2.
Câu 3: Cho biết số hiệu nguyên tử của Zn là 30. Vị trí của Zn trong bảng tuần hoàn là?
A. Ô 30, chu kì 4, nhóm IIA. B. Ô 30, chu kì 5, nhóm IIB.
C. Ô 30, chu kì 4, nhóm IIB. D. Ô 30, chu kì 3 nhóm IIB.
Hướng dẫn giải
Đáp án A
Cấu hình electron của Zn là: [Ar]3d104s2
Zn ở ô 30 (z = 30), chu kỳ 4 (4 lớp electron), nhóm IIB (2 electron hóa trị, nguyên tố d).
Câu 4: Dãy oxit nào sau đây có tính lưỡng tính?
A. MgO, ZnO. B. ZnO, CaO.
C. MgO, Al2O3. D. ZnO, Al2O3.
Hướng dẫn giải
Đáp án D
ZnO, Al2O3 có tính lưỡng tính.
Câu 5: Để bảo vệ vỏ tàu biển bằng thép bằng phương pháp điện hóa người ta dùng kim loại nào sau đây?
A. Cu. B. Pb. C. Zn. D. Sn.
Hướng dẫn giải
Đáp án C
Để chống ăn mòn, người ta dùng một kim loại có tính khử lớn hơn Fe, thường là Zn, ghép vào vỏ tàu biển bằng thép để bảo vệ vỏ tàu, như thế Zn sẽ bị ăn mòn điện hóa trước.
Câu 6: Khi điều chế Zn từ dung dịch ZnSO4 bằng phương pháp điện phân với điện cực trơ, ở anot xảy ra quá trình nào sau đây?
A. Khử ion kẽm. B. Khử nước.
C. Oxi hóa nước. D. Oxi hóa kẽm.
Đáp án: C
Điện phân ZnSO4
Anot (+): oxi hóa nước: 2H2O → 4H+ + O2 +4e
Catot (-): khử Zn2+: Zn2+ + 2e → Zn
Câu 7: Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được hỗn hợp gồm 0,12 mol khí NO2 và 0,08 mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
A. 3,24. B. 8,1.
C. 6,48. D. 10,8.
Hướng dẫn giải
Đáp án A
Bảo toàn số mol electron:
→ 3nAl = + 3nNO
→ 3.nAl = 0,12 + 3.0,08
→ nAl = 0,12 mol
→ mAl = 0,12.27 = 3,24g
Câu 8: Cho phương trình phản ứng: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O.
Tỉ lệ a : b là
A. 1 : 3. B. 2 : 3.
C. 2 : 5. D. 1 : 4
Hướng dẫn giải
Đáp án D
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
→ a : b = 1 : 4
Câu 9: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít. B. 0,336 lít.
C. 0,747 lít. D. 1,792 lít.
Hướng dẫn giải
Đáp án A
nCu = 3,2 : 64 = 0,05 mol
= 0,8.0,1 + 2.0,2.0,1 = 0,12 mol
= 0,8.0,1 = 0,08 mol
3Cu+ 8H++ 2NO3- → 3Cu2+ + 2NO + 4H2O
→ Sau phản ứng H+ hết đầu tiên
→ nNO = = = 0,03 mol
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 10: Tổng hệ số là các số nguyên, tối giản của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 8. B. 10. C. 11. D. 9.
Hướng dẫn giải
Đáp án B
Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O
Tổng hệ số = 1 + 4 + 1 + 2 + 2 = 10.
Câu 11: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl dư, sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư nitric acid đặc, nguội, sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,5. B. 11,5. C. 12,3. D. 15,6.
Hướng dẫn giải
Đáp án C
Gọi số mol Al và Cu trong m gam hỗn hợp X lần lượt là a và b mol
Trường hợp 1: Cho X vào HCl dư, chỉ có Al phản ứng
2Al + 6HCl → 2AlCl3 + 3H2 (0,15 mol)
→ nAl = = = 0,1 mol
Trường hợp 2: Cho X vào HNO3 đặc, nguội Al bị thụ động, chỉ có Cu phản ứng
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 (0,3 mol) + 2H2O
→ nCu = = 0,15 mol→ m = mAl + mCu = 0,1.27 + 0,15.64 = 12,3 gam.
Câu 12:Cho hỗn hợp gồm 2,8g Fe và 3,2g Cu vào dung dịch HNO3 thu được dung dịch A, V lít khí NO2 ở đktc (sản phẩm khử duy nhất) và còn dư 1,6g kim loại. Biết các phản ứng xảy ra hoàn toàn. Khối lượng muối thu được khi cô cạn dung dịch A và giá trị của V là:
A. 10,6g và 2,24 lít B. 14,58g và 3,36 lít
C. 16.80g và 4,48 lít D. 13,7g và 3,36 lít
Hướng dẫn giải
Đáp án D
Dư 1,6g kim loại → mCu dư = 1,6g; dung dịch A gồm: Fe(NO3)2; Cu(NO3)2
→ nCu phản ứng = 3,2 – 1,6 = 1,6 gam
→ = nCu phản ứng = = 0,025 mol
→ = 0,025.188 = 4,7 gam
= 0,05 mol
→= 0,05.180 = 9 gam
→ m muối = 4,7 + 9 = 13,7 gam
Bảo toàn electron
→= 2nFe + 2nCu phản ứng = 2. 0,05 + 2. 0,025 = 0,15 mol
→
Xem thêm các phương trình hóa học hay khác:
- 2Zn + O2 → 2ZnO
- Zn + Cl2 → ZnCl2
- Zn + Br2 → ZnBr2
- Zn + I2 → ZnI2
- Zn + S → ZnS
- Zn + 2HCl → ZnCl2 + H2
- Zn + 2H2SO4 → ZnSO4 + H2
- Zn + 2H3PO4 → Zn3(PO4)2 + 3H2
- Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
- 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
- 5Zn + 12HNO3 → 5Zn(NO3)2 + N2+ 6H2O
- 3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
- Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O
- 3Zn + 4H2SO4 → 3ZnSO4 + S + 4H2O
- 4Zn + 5H2SO4 → 4ZnSO4 + H2S + 4H2O
- Zn + 2CH3COOH → (CH3COO)2Zn + H2
- Zn + 2FeCl3 → ZnCl2 + 2FeCl2
- Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
- Zn + 2Fe2(SO4)3 → ZnSO4 + 2FeSO4
- 3Zn + 2Fe2(SO4)3 → 3ZnSO4 + 2Fe
- 3Zn + 2Fe(NO3)3 → 3Zn(NO3)2 + 2Fe
- 3Zn + 2FeCl3 → 3ZnCl2 + 2Fe
- Zn + CuCl2 → ZnCl2 + Cu
- Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
- Zn + CuSO4 → ZnSO4 + Cu
- Zn + PbSO4 → ZnSO4 + Pb
- Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
- Zn + 2AgNO3 → Zn(NO3)2 + Ag
- 8NaNO3 + 7NaOH + 4Zn → 2H2O + NH3+4Na2ZnO2
- 2NaOH + Zn → Na2ZnO2 + H2
- ZnO + H2SO4 → ZnSO4 + H2O
- ZnO + 2NaOH → Na2ZnO2 + H2O
- Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
- Zn(OH)2 ↓+ 2NaOH → Na2ZnO2 + 2H2O
- ZnS + H2SO4 → ZnSO4 + H2S↑
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



