C2H4 (Ethylene) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
Bài viết về tính chất hóa học của C2H4 (Ethylene) gồm đầy đủ định nghĩa, công thức phân tử, công thức cấu tạo, tên gọi, tính chất hóa học, tính chất vật lí, cách điều chế và ứng dụng.
C2H4 (Ethylene) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
I. Định nghĩa C2H4
- Định nghĩa: Ethylene (C2H4) là một hyđrocacbon không no nằm trong dãy đồng đẳng của alkene. Ethylene là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (d=28/29 ).
- Công thức phân tử: C2H4.
- Công thức cấu tạo: 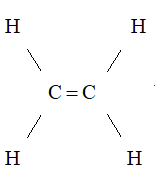
- Danh pháp
+ Tên quốc tế: C2H4 có tên gọi là etilen
+ Tên nhóm CH2=CH2- được gọi là nhóm vinyl.
II. Tính chất vật lí của C2H4 & nhận biết
- Ethylene là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (d= 28/29 ).
- Nhận biết:
+ Cách 1: Dẫn khí Ethylene qua dung dịch brom màu da cam. Hiện tượng: Dung dịch brom bị mất màu.
+ Cách 2: Dẫn khí Ethylene qua dung dịch Potassium permangante. Hiện tượng: Dung dịch Potassium permangante bị mất màu.
III. Tính chất hóa học của C2H4
- Trong phân tử etilen, mỗi nguyên tử cacbon liên kết với hai nguyên tử hiđro, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
- Công thức cấu tạo của etilen:

Viết gọn: CH2=CH2.
- Giữa hai nguyên tử cacbon có hai liên kết. Những liên kết như vậy được gọi là liên kết đôi.Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học.
1. Phản ứng cộng
- Phản ứng cộng halogen (phản ứng halogen hóa)
- Cộng brom
- Dẫn khí Ethylene qua dung dịch brom màu da cam
- Hiện tượng: Dung dịch brom bị mất màu.
- Nhận xét: Ethylene đã phản ứng với brom trong dung dịch.
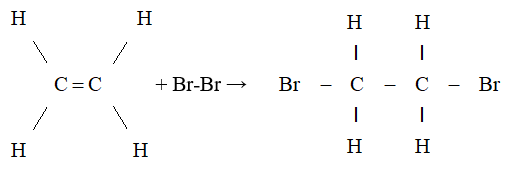
- Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử Ethylene đã kết hợp thêm một phân tử brom. Phản ứng trên được gọi là phản ứng cộng.
- Ngoài brom, trong những điều kiện thích hợp, Ethylene còn có phản ứng cộng với một số chất khác. Ví dụ hiđro, clo.
- Nhìn chung, các chất có liên kết đôi (tương tự như etilen) dễ tham gia phản ứng cộng.
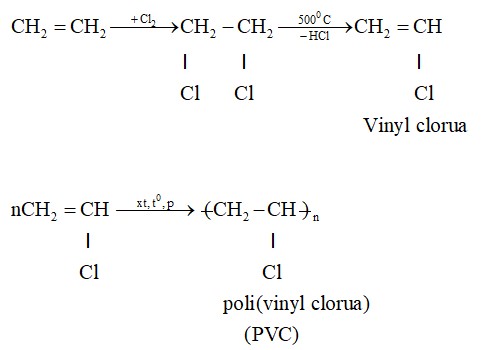
- Cộng clo
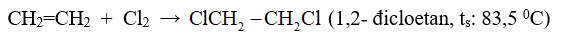
- Phản ứng cộng hiđro (phản ứng hiđro hóa)
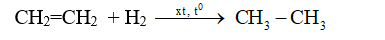
- Phản ứng cộng axit
- Hiđro halogenua (HCl, HBr, HI), axit sunfuric đậm đặc ,... có thể cộng vào etilen.
CH2=CH2 + HCl (khí ) → CH3CH2Cl : (Ethyl clorua)
CH2=CH2 + H-OSO3H → CH3CH2OSO3H : (Ethyl hiđrosunfat )
- Phản ứng cộng nước (phản ứng hiđrat hóa)
- Ở nhiệt độ thích hợp và có xúc tác axit, Ethylene có thể cộng nước.
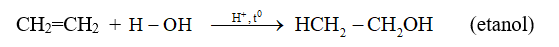
2. Phản ứng trùng hợp
- Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác), liên kết kém bền trong phân tử Ethylene bị đứt ra. Khi đó, các phân tử Ethylene kết hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn, gọi là polyethylene (viết tắt là PE).

- Phản ứng trên được gọi là phản ứng trùng hợp.
- Polyethylene là chất rắn, không tan trong nước, không độc. Nó là nguyên liệu quan trọng trong công nghiệp chất dẻo.
3. Phản ứng oxi hóa
- Ethylene cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C2H4 + 3O2 → 2CO2 + 2H2O
- Ethylene làm mất màu dung dịch KMnO4:
2 CH2=CH2 + 2KMnO4 + 4H22O → + 2MnO2 + 2KOH (ethylene glycol)
- Phản ứng làm mất màu dung dịch thuốc tím Potassium permangante được dùng để nhận ra sự có mặt của liên kết đôi của alkene.
IV. Điều chế C2H4
- Trong công nghiệp, Ethylene được điều chế bằng phản ứng tách hiđro từ alkane tương ứng hoặc bằng phản ứng craking.
- Trong phòng thí nghiệm, Ethylene được điều chế bằng cách đun ethanol với axit sunfunric đậm đặc:
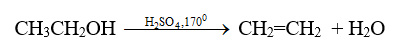
V. Ứng dụng của C2H4
- Trong các hợp chất hữu cơ do con người sản xuất thì Ethylene đứng hàng đầu về sản lượng. Sở dĩ như vậy vì Ethylene cũng là nguyên liệu quan trọng của công nghiệp tổng hợp polymer và các hợp chất hữu cơ khác.
- Tổng hợp polymer
+ Trùng hợp Ethylene người ta thu được các polymer để chế tạo màng mỏng.... dùng cho nhiều mục đích khác nhau.
+ Chuyển hóa Ethylene thành các monome khác để tổng hợp ra hàng loạt polymer đáp ứng nhu cầu phong phú của đời sống và kĩ thuật.
- Tổng hợp các hóa chất khác
+ Từ Ethylene tổng hợp ra những hóa chất hữu cơ thiết yếu như ethanol, ethylene glycol, aldehyde acetic,....
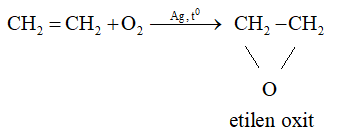
- Ethylene dùng để kích thích quả mau chín.
Xem thêm tính chất hóa học của các chất khác:
- Tính chất của C3H6 (Propene)
- Tính chất của C4H8 (Butene)
- Tính chất của C5H10 (Pentene)
- Tính chất của C6H12 (Hexene)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Wiki tính chất hóa học trình bày toàn bộ tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

