Tính pH của dung dịch axit, bazơ yếu (chi tiết nhất)
Bài viết Tính pH của dung dịch axit, bazơ yếu chi tiết nhất giúp học sinh nắm vững kiến thức trọng tâm Hóa học 11.
Tính pH của dung dịch axit, bazơ yếu (chi tiết nhất)
(199k) Xem Khóa học Hóa 11 KNTTXem Khóa học Hóa 11 CDXem Khóa học Hóa 11 CTST
I. Phương pháp giải
Tương tự như axit mạnh.
Sử dụng kết hợp công thức tính độ điện li α, hằng số điện li axit, bazo: Ka, Kb
- Độ điện li α của chất điện li là tỉ số giữa số phân tử phân li ra ion (n) và tổng số phân tử hòa tan (no)
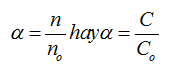
- Hằng số phân li axit: HA ⇌ H+ + A-

- Hằng số phân li bazơ: BOH ⇌ B+ + OH-

II. Ví dụ
Bài 1: Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a. Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b. Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
Trả lời
a. nNH4Cl = 1,07/53,5 = 0,02 => CM(NH4Cl) = 0,02/2 = 0,01 M
Phương trình điện li:
NH4Cl → NH4+ + Cl-
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01
Điện ly: x x x
Sau điện li: 0,01-x x x
Kb = x2/(0,01-x) = 1,8.10-5 => x = 4,24.10-4 => pH = 3,37
b. Phương trình điện li:
HCl → H+ + Cl+
NH4+ + H2O ⇌ NH3 + H3O+
Ban đầu 0,01 0,001
Điện ly x x x
Sau điện li: 0,01-x x x+0,001
Kb = (x.(x+0,001))/(0,01-x) = 1,8.10-5 => x = 3,69.10-4 => pH = 3,43
Bài 2: Dung dịch A chứa NH3 0,1M và NaOH 0,1M. Tính pH của dung dịch biết Kb của NH3 = 1,75.10-5.
Trả lời
Phương trình điện li
NaOH → Na+ + OH-
NH3 + H2O ⇌ NH4+ + OH+
Ban đầu: 0,1 0,1
Điện ly: x x x
Sau điện li: 0,1-x x x+0,1
Kb = (x.(0,1+x))/(0,1-x) = 1,75.10-5 => x = 1,75.10-3 => pOH = 4,76 => pH = 9,24
(199k) Xem Khóa học Hóa 11 KNTTXem Khóa học Hóa 11 CDXem Khóa học Hóa 11 CTST
Xem thêm Chuyên đề lý thuyết và các dạng bài tập Hóa học lớp 11 hay khác:
- Sự điện li; Phân loại các chất điện li
- Axit, bazo, muối; pH của dung dịch
- Phản ứng trao đổi của ion
- Chất điện li; Phương trình điện li; Nồng độ các ion trong dung dịch
- Bài tập Chất điện li; Phương trình điện li; Nồng độ các ion trong dung dịch
- Axit, bazơ, chất lưỡng tính theo Areniut và Bronsted; Hằng số phân li axit yếu (Ka) và bazơ yếu (Kb)
- Bài tập Axit, bazơ, chất lưỡng tính theo Areniut và Bronsted; Hằng số phân li axit yếu (Ka) và bazơ yếu (Kb)
- Tính pH của dung dịch axit, bazơ mạnh
- Bài tập Tính pH của dung dịch axit, bazơ mạnh
- Bài tập Tính pH của dung dịch axit, bazơ yếu
- Bài toán về pha loãng, pha trộn dung dịch các chất điện li để đạt được pH định trước
- Bài tập về pha loãng, pha trộn dung dịch các chất điện li để đạt được pH định trước
- Định luật bảo toàn điện tích và cách giải
- Bài tập về Định luật bảo toàn điện tích
- Phương trình ion rút gọn và cách giải bài tập
- Bài tập về Phương trình ion rút gọn
- Phản ứng thủy phân của muối
- Bài tập Phản ứng thủy phân của muối
Xem thêm các tài liệu học tốt lớp 11 hay khác:
- Giải Chuyên đề học tập Hóa 11 Kết nối tri thức
- Giải Chuyên đề học tập Hóa 11 Chân trời sáng tạo
- Giải Chuyên đề học tập Hóa 11 Cánh diều
- Giải lớp 11 Kết nối tri thức (các môn học)
- Giải lớp 11 Chân trời sáng tạo (các môn học)
- Giải lớp 11 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

