Đề thi Học kì 2 Hóa học 9 năm 2026 có đáp án (5 đề)
Để học tốt Hóa học 9, dưới đây là danh sách Top 5 Đề thi Học kì 2 Hóa học 9 có đáp án năm 2026, cực sát đề thi chính thức. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi Hóa học 9.
Đề thi Học kì 2 Hóa học 9 năm 2026 có đáp án (5 đề)
Chỉ từ 150k mua trọn bộ Đề thi Hóa học 9 Cuối kì 2 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Đề 1)
Phần tự luận
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án và hướng dẫn giải
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
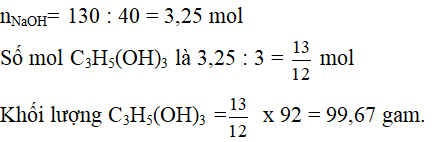
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Đề 2)
Phần tự luận
Câu 1: (2 điểm) Nhỏ 10ml dung dịch AgNO3 1M trong NH3 vào ống nghiệm đựng dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Câu 2: (2 điểm) Viết phương trình hóa học của H2N – CH2 – COOH lần lượt với NaOH, C2H5OH.
Câu 3: (2 điểm) Hai phân tử X và Y có công thức cấu tạo lần lượt là:
HO – CH2 – COOH và H2N – CH2 – COOH. Viết các phương trình hóa học với NaCâu 4: (2 điểm) Hãy điền Đ (nếu đúng) S (nếu sai) vào bảng sau:
| STT | Đ hay S | |
| 1 | Glucozo tác dụng được với AgNO3 trong NH3 | |
| 2 | Saccarozo tác dụng được với H2O trong axit | |
| 3 | Xenlulozo không tác dụng với natri | |
| 4 | Tinh bột tác dụng với iot cho màu xanh | |
| 5 | Axit axetic tác dụng được với rượu etylic trong axit | |
| 6 | Amino axit bị thủy phân trong môi trường axit hay kiềm | |
| 7 | Rượu etylic tác dụng với natri | |
| 8 | Benzen không tác dụng với nước |
Câu 5: (2 điểm) Trộn 50ml axit axetic (D = 1,03 g/cm3) với 50ml nước cất (D = 1 g/cm3). Tính nồng độ % của axit axetic trong dung dịch đó.
Đáp án và hướng dẫn giải
Câu 1:
nAgNO3 ban đầu = 0,01 mol.
nAg tạo ra = 0,864/108 = 0,008 mol
Hiệu suất phản ứng =
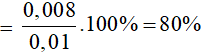
Câu 2:
Viết phương trình hóa học:
H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O
H2N – CH2 – COOH + C2H5OH ⇋ H2N – CH2 – COOC2H5 + H2O
Câu 3:
HO – CH2 – COOH + 2Na → NaO – CH2 – COONa + H2
2H2N – CH2 – COOH + 2Na → 2H2N – CH2 – COONa + H2
Câu 4: Chỉ có 6 sai (S).
Câu 5:
Khối lượng axit axetic = 50 x 1,03 = 51,5 gam
Khối lượng nước = 50 gam
Khối lượng dung dịch axit sau khi trộn = 50 + 51,5 = 101,5 gam.
Nồng độ % của axit axetic là:
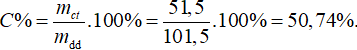
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Đề 3)
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học của khí SO2 với dung dịch KOH.
Câu 2: (2 điểm) Tính thể tích dung dịch CH3COOH 1,25M cần để trung hòa 60ml dung dịch NaOH 0,75M.
Câu 3: (2 điểm) Cho một dây nhôm vào dung dịch Cu(NO3)2. Sau một thời gian lấy dây nhôm ra khỏi dung dịch. Nhận xét hiện tượng.
Câu 4: (2 điểm) Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO3 trong NH3. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 5: (2 điểm) Khi đốt cùng số mol các chất: rượu etylic, axit axetic và glucozo cần các thể tích khí oxi (đktc) lần lượt là V1, V2, V3.
Xác định thứ tự tăng dần của V1, V2, V3.
Đáp án và hướng dẫn giải
Câu 1:
SO2 + KOH → KHSO3
SO2 + 2KOH → K2SO3+ H2O
Câu 2:
CH3 – COOH + NaOH → CH3–COONa + H2O
nNaOH = 0,06 x 0,75 = 0,045 mol = nCH3COOH
Thể tích dung dịch CH3–COOH cần dùng = 0,045/1,25 = 0,036 (lít) hay 36ml.
Câu 3:
2Al + 3CuSO4 (dd màu xanh) → 3Cu + Al2(SO4)3
- Dây nhôm nhuốm màu đỏ.
- Màu xanh của dung dịch phai dần.
Câu 4:
C6H12O6 + Ag2O NH3→ C6H12O7 + 2 Ag
nAg = 2 x 0,1 x 0,1 = 0,02 mol => mAg = 0,02 x 108 = 2,16 gam
Câu 5:
C2H5OH + 3O2 to→ 2CO2 + 3H2O
CH3 – COOH + 2O2 to→ 2CO2 + 2H2O
C6H12O6 + 6O2 to→ 6CO2 + 6H2O
Từ các phản ứng suy ra: V2 < V1 < V3.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Đề 4)
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học (điều kiện thích hợp) của cacbon lần lượt tác dụng với các chất sau: CuO, Fe2O3, O2.
Câu 2: (2 điểm) Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic.
Bằng phương pháp hóa học nhận biết từng chất.
Câu 3: (2 điểm) Một chất béo có công thức: C15H31COO-CH(CH2-OOC17H35)2 bị thủy phân trong dung dịch NaOH. Hãy viết phương trình hóa học.
Câu 4: (2,5 điểm) Sục khí CO2 vào dung dịch NaOH dư. Viết phương trình hóa học.
Sau phản ứng trong dung dịch sẽ tồn tại những chất gì?
Câu 5: (2,5 điểm) Tính nồng độ % của dung dịch rượu etylic 70° (biết DC2H5OH = 0,8 g/ml, DH2O = 1 g/ml, H=1, C=12, O=16).
Đáp án và hướng dẫn giải
Câu 1:
2CuO + C to→ 2Cu + CO2
2Fe2O3 + 3C to→ 4Fe + 3CO2
O2 + C to→ CO2
Câu 2: Có thể dùng BaCO3:
- Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi ống nghiệm một ít BaCO3.
- Ống nghiệm nào BaCO3 tan dần, có khí thoát ra là ống nghiệm chứa axit axetic.
- Ống nghiệm nào vừa có khí thoát ra vừa có kết tủa trắng là ống nghiệm chứa H2SO4.
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
BaCO3 + 2CH3COOH → (CH3COO)2Ba + CO2↑ + H2O
- Ống nghiệm nào không thấy hiện tượng gì là ống nghiệm chứa rượu etylic.
Câu 3:
C15H31COO–CH(CH2–OOCC17H35)2 + 3NaOH to→ C3H5(OH)3 + C15H31COONa + 2C17H35COONa
Câu 4:
CO2 + 2NaOH → Na2CO3+ H2O.
Trong dung dịch sau phản ứng có: Na2CO3, NaOH (dư).
Câu 5:
Trong 100ml dung dịch rượu etylic 70⁰ có 70ml rượu etylic và 30ml nước.
Khối lượng rượu etylic = 70 x 0,8 = 56 gam, khối lượng nước = 30 gam.
Khối lượng dung dịch = 56 + 30 = 86 gam.
Nồng độ % dung dịch rượu etylic
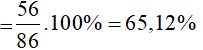
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Đề 5)
Phần trắc nghiệm (Mỗi câu 0,5 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là
A. C2H2, C6H6, CH4
B. C2H2, CH4, C2H4
C. C2H2, C2H4
D. C2H2, H2, CH4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br2 0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br2 không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch?
A. K2CO3 và HCl
B. NaNO3 và KHCO3
C. K2CO3 và Ca(OH)2
D. KHCO3 và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam, a là khối lượng của
A. dung dịch brom
B. khối lượng brom
C. axetilen
D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là
A. CH3COOH, (C6H10O5)n
B. CH3COOC2H5, C2H5OH
C. CH3COOH, C6H12O6
D. CH3COOH, CH3COOC2H5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H2, CH3CH2ONa
B. H2, NaOH
C. NaOH, H2O
D. CH3CH2ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C2H5OH chứa trong 1 lít rượu đó là
A. 850 ml B. 150 ml C. 300 ml D. 450 ml
Câu 8: Chỉ dùng dung dịch iot và dung dịch AgNO3 trong NH3 có thể phân biệt được các chất trong mỗi dãy của dãy nào sau đây?
A. axit axetic, glucozo, saccarozo
B. xenlulozo, rượu etylic, saccarozo
C. hồ tinh bột, rượu etylic, glucozo
D. benzene, rượu etylic, glucozo
Phần tự luận (6 điểm)
Câu 9: (2 điểm) Hãy viết phương trình hóa học và ghi rõ điều kiện của các phản ứng sau:
1. Trùng hợp etilen.
2. Axit axetic tác dụng với magie.
3. Oxi hóa rượu etylic thành axit axetic.
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác
Câu 10: (2 điểm) Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau: FeS2 → SO2 → SO3 → H2SO4 → CH3COOH
Câu 11: (2 điểm) Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp.
(cho O=16, C=12, H=1)
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | C | B | C | C | D | A | B | C |
Câu 1:C
Phân tử của chúng có liên kết ba và liên kết đôi.
Câu 2:B
nC2H4 = 0, 025 mol ; nBr2 = 0,04 lớn hơn số mol C2H4.
Nên còn màu da cam của dung dịch brom chỉ nhạt đi, không mất màu hẳn.
Câu 3:C
NaNO3 không tác dụng với KHCO3.
Câu 4:C
Dung dịch brom dư đã tác dụng và giữ hết axetilen.
Câu 5:D
C2H5OH, ( C6H10O5 )n không phản ứng với dung dịch NaOH.
Câu 6:A
2C2H5OH + 2Na → 2CH3CH2ONa + H2
Câu 7:B
Thể tích C2H5OH = 1000.0,15 = 150 ml.
Câu 8:C
Dùng dung dịch iot nhận ra được hồ tinh bột. dung dịch AgNO3 trong NH3 có thể phân biệt được rượu etylic và glucozo.
Câu 9:
1. Trùng hợp etilen: nCH2=CH2 to, xt, p→ (-CH2-CH2-)n
2. Axit axetic tác dụng với magie: 2CH3COOH + Mg → (CH3COO)2Mg + H2
3. Oxi hóa rượu etylic thành axit axetic:
C2H5OH + O2 men giấm→ CH3COOH + H2O
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác.
CH3COOH + C2H5OH to, xt⇋ CH3COOC2H5 + H2O
Câu 10:
Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau:
4FeS2 + 11O2 to→ 8SO2 + 2Fe2O3
2SO2 + O2 to, xt⇋ 2SO3
SO3 + H2O → H2SO4
H2SO4+ 2CH3COONa → 2CH3COOH + Na2SO4
Câu 11:
Dung dịch brom (dư) nên khối lượng dung dịch tăng bằng khối lượng C2H2 bị giữ lại tức bằng 1,3 gam.
C2H2 + 2Br2 → C2H2Br4
nC2H2 = 1,3/26 = 0,05 mol. Suy ra nBr2 = 0,05 x 2 = 0,1 mol.
Khối lượng brom tham gia phản ứng: 0,1 x 189 = 18 (gam).
Thành phần % về thể tích của C2H2 là 50%.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các đề kiểm tra, đề thi Hóa học 9 chọn lọc, có đáp án hay khác:
- Đề thi Hóa học 9 Giữa kì 1 năm 2026 có đáp án (3 đề)
- Đề thi Học kì 1 Hóa học 9 năm 2026 có đáp án (9 đề)
- Đề thi Hóa học 9 Giữa kì 2 năm 2026 có đáp án (3 đề)
Loạt bài Đề thi Hóa lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



