C4H10 (Butane) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
Bài viết về tính chất hóa học của C4H10 (Butane) gồm đầy đủ định nghĩa, công thức phân tử, công thức cấu tạo, tên gọi, tính chất hóa học, tính chất vật lí, cách điều chế và ứng dụng.
C4H10 (Butane) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
I. Định nghĩa butan
- Định nghĩa: Butan (C4H10) là một hyđrocacbon no thuộc dãy đồng đẳng của alkane. Butan là chất khí, không màu, không mùi.
- Công thức phân tử: C4H10.
- Công thức cấu tạo: 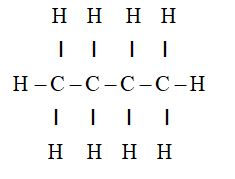
- Đồng phân
Đồng phân mạch cacbon (Từ C4H10 trở đi mới có mạch cacbon)
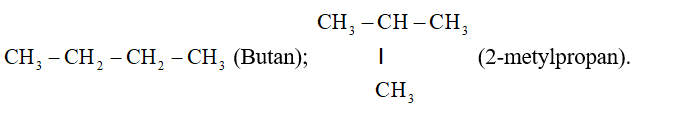
- Danh pháp
+ alkane không phân nhánh
• Tên alkane: Tên mạch cacbon + an
CH3-CH2-CH2-CH3 - (Butan)
• Tên gốc ankyl: Tên mạch cacbon chính + yl
CH3CH2CH2CH2 - (Butyl)
+ Ankan phân nhánh
• Số chỉ vị trí nhánh + tên nhánh + tên mạch chính + an
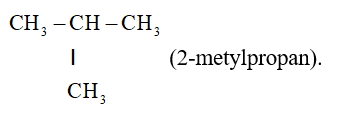
II. Tính chất vật lí của butan & nhận biết
- Butan là chất khí, không màu, dễ cháy, dễ hóa lỏng. Butan có trong khí thiên nhiên, khí chế biến dầu.
III. Tính chất hóa học của butan
- Trong phân tử C4H10 chỉ có liên kết và . Đó là các liên kết xích ma bền vững, vì thế C4H10 tương đối trơ về mặt hóa học: Ở nhiệt độ thường, chúng không phản ứng với axit, bazơ và chất oxi hóa mạnh (như KMnO4) Dưới tác dụng của ánh sáng, xúc tác, nhiệt, C4H10 tham gia các phản ứng thế, phản ứng tách và phản ứng oxi hóa.
1. Phản ứng thế bởi halogen
- Khi chiếu sáng hoặc đốt nóng hỗn hợp butan và clo sẽ xảy ra phản ứng thế lần lượt các nguyên tử hidro bằng clo. Tương tự như methane.
C4H10 + Cl2 → C4H9Cl + HCl
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
2. Phản ứng tách (gãy liên kết C-C và C-H)
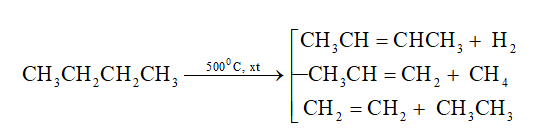
- Dưới tác dụng của nhiệt và xúc tác (Cr2O3, Fe, Pt,...), các alkane không những bị tách hidro tạo thành các hydrocarbon không no mà còn bị gãy các liên kết C-C tạo ra các phân tử nhỏ hơn.
3. Phản ứng oxi hóa
- Khi đốt, butan bị cháy tạo ra CO2, H2O và tỏa nhiều nhiệt

- Nếu không đủ oxi, alkane bị cháy không hoàn toàn, khi đó ngoài CO2 và H2O còn tạo ra các sản phẩm như CO, than muội, không những làm giảm năng suất tỏa nhiệt mà còn gây độc hại cho môi trường.
IV. Điều chế butan
- Điều chế bằng cách cho Ethyl clorua (hoặc Ethyl bromua) tác dụng với natri (kim loại), dạng iso được điều chế bằng cách đồng phân hóa n-butan dưới tác dụng của AlCl3 và HCl ở nhiệt độ 90 - 105 , 10-12 atm hoặc trên các chất xúc tác axit rắn.
C4H6 + 2H2 → C4H10
V. Ứng dụng của butan
- Dùng làm nhiên liệu điều chế butadiene, isobutilen và xăng tổng hợp
Xem thêm tính chất hóa học của các chất khác:
- Tính chất hóa học của CH4 (Methane)
- Tính chất của C2H6 (Ethane)
- Tính chất hóa học của C3H8 (Propane)
- Tính chất hóa học của C5H12 (Pentane)
- Tính chất hóa học của C6H14 (Hexane)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Wiki tính chất hóa học trình bày toàn bộ tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

