Cr (Chromium) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
Bài viết về tính chất hóa học của Cr (Chromium) gồm đầy đủ thông tin cơ bản về Cr trong bảng tuần hoàn, tính chất hóa học, tính chất vật lí, cách điều chế và ứng dụng.
Cr (Chromium) (Tính chất hóa học, vật lí, nhận biết, điều chế, ứng dụng)
I. Định nghĩa Cr (Chromium)
- Crom là một nguyên tố hóa học trong bảng tuần hoàn có ký hiệu Cr và số hiệu nguyên tử bằng 24, là nguyên tố đầu tiên của nhóm 6, là 1 kim loại cứng, giòn, có độ nóng chảy cao.
- Kí hiệu: Cr
- Cấu hình electron: 1s22s22p63s23p63d54s1 hay [Ar]3d54s1.
- Số hiệu nguyên tử: 24
- Khối lượng nguyên tử: 52 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 24
+ Nhóm: VIB
+ Chu kì: 4
- Đồng vị: 40Cr, 51Cr, 52Cr, 53Cr, 54Cr.
- Độ âm điện: 1,66
II. Tính chất vật lí của Cr (Chromium) & nhận biết
Tính chất vật lí:
- Crom là kim loại màu trắng bạc, có khối lượng riêng lớn (d = 7,2 g/cm3), tonc = 1890oC.
- Là kim loại cứng nhất, có thể rạch được thuỷ tinh.
III. Tính chất hóa học của Cr (Chromium)
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1 → +6 (hay gặp +2, +3 và +6).
1. Tác dụng với phi kim
2. Tác dụng với nước
Cr bền với nước và không khí do có lớp màng oxit rất mỏng, bền bảo vệ. Người ta mạ crom lên sắt để bảo vệ sắt và dùng Cr để chế tạo thép không gỉ.
3. Tác dụng với axit
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Cr không tác dụng với dung dịch HNO3 hoặc H2SO4 đặc, nguội.
IV. Trạng thái tự nhiên của Cr (Chromium)
- Crom là nguyên tố phổ biến thứ 21 trong vỏ Trái Đất với nồng độ trung bình 100 ppm. Các hợp chất crom được tìm thấy trong môi trường do bào mòn các đá chứa crom và có thể được cung cấp từ nguồn núi lửa.
- Crom được khai thác dưới dạng quặng cromit (FeCr2O4).
IV. Điều chế Cr (Chromium)
- Dùng phản ứng nhiệt nhôm
V. Ứng dụng của Cr (Chromium)
- Trong ngành luyện kim, để tăng cường khả năng chống ăn mòn và đánh bóng bề mặt như là một thành phần của hợp kim, chẳng hạn trong thép không gỉ để làm dao, kéo.
- Làm thuốc nhuộm và sơn:
- Các muối crom nhuộm màu cho thủy tinh thành màu xanh lục của ngọc lục bảo.
- Crom là thành phần tạo ra màu đỏ của hồng ngọc, vì thế nó được sử dụng trong sản xuất hồng ngọc tổng hợp.
VI. Các hợp chất quan trọng của Crom
1. Hợp chất crom (III)
a) Chromium (III) oxide - Cr2O3
Chromium (III) hydroxide - Cr(OH)3
2. Hợp chất crom (VI)
a) Chromium (VI) oxide - CrO3
b) Muối crom (VI): CrO42-, Cr2O72-
Xem thêm tính chất hóa học của các chất khác:
- Tính chất của CrO (Chromium (II) oxide)
- Tính chất của Cr(OH)2 (Chromium (II) hydroxide)
- Tính chất của CrCl2 (Chromium (II) chloride)
- Tính chất của Cr2O3 (Chromium (III) oxide)
- Tính chất của Cr(OH)3 (Chromium (III) hydroxide)
- Tính chất của Cr(NO3)3 (Chromium (III) nitrate)
- Tính chất của CrCl3 (Chromium (III) chloride)
- Tính chất của Cr2(SO4)3 (Chromium (III) sulfate)
- Tính chất của CrO3 (Chromium (VI) oxide)
- Tính chất của muối chromate và dichromate
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Wiki tính chất hóa học trình bày toàn bộ tính chất hóa học, vật lí, nhận biết, điều chế và ứng dụng của tất cả các đơn chất, hợp chất hóa học đã học trong chương trình Hóa học cấp 2, 3.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

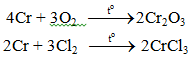
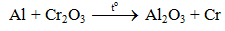



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

