Công thức Hóa học vô cơ lớp 11 chương trình mới (hay, chi tiết)
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ kiến thức & công thức môn Hóa học 11, VietJack biên soạn tóm tắt Công thức Hóa học vô cơ lớp 11 chương trình mới hay, chi tiết. Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa 11.
Công thức Hóa học vô cơ lớp 11 chương trình mới (hay, chi tiết)
(199k) Xem Khóa học Hóa 11 KNTT Xem Khóa học Hóa 11 CD Xem Khóa học Hóa 11 CTST
(199k) Xem Khóa học Hóa 11 KNTT Xem Khóa học Hóa 11 CD Xem Khóa học Hóa 11 CTST
Lưu trữ: Tóm tắt công thức Hóa học vô cơ lớp 11 (sách cũ)
- Tóm tắt công thức Hóa học lớp 11 Chương 1
- Tóm tắt công thức Hóa học lớp 11 Chương 2
- Tóm tắt công thức Hóa học lớp 11 Chương 3
CHƯƠNG I: SỰ ĐIỆN LI
1. Độ điện li (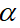 )
)
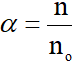
Trong đó:
n là số phân tử phân li ra ion; no là tổng số phân tử hòa tan.
2. Hằng số phân li axit (Ka)
Xét ví dụ: CH3COOH 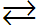 CH3COO- + H+
CH3COO- + H+
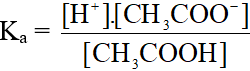
3. Hằng số phân li bazơ
Xét ví dụ: NH3 + H2O 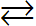 NH4+ + OH-
NH4+ + OH-
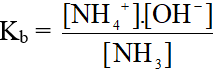
4. Tích số ion của nước
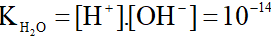
5. Tính pH
Quy ước: [H+] = 1,0.10-pH M. Nếu [H+] = 10-aM thì pH = a.
Công thức: pH = -log[H+]
Hoặc pH = 14 + log[OH-].
6. Quan hệ giữa pH và môi trường
pH = 7: Môi trường trung tính;
pH < 7: Môi trường axit;
pH > 7: Môi trường bazơ.
CHƯƠNG II. NITƠ – PHOTPHO
1. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:
nHNO3 = 4nNO + 2nNO2 + 10nN2O +12nN2 +10nNH4NO3
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
+) Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
+) Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
2. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):
mmuối = mKL + 62.(3nNO + nNO2 + 8nN2O +10nN2)
Lưu ý:
+) Không tạo ra khí nào thì số mol khí đó bằng 0.
+) Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
3. Tính hiệu suất phản ứng tổng hợp NH3:
Nếu tiến hành tổng hợp NH3 từ hỗn hợp gồm N2 và H2 với tỉ lệ mol tương ứng là 1:3 thì hiệu suất tổng hợp là:
H% = 2 – 2.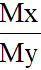
Với X là hỗn hợp ban đầu và Y là hỗn hợp sau.
4. Bài toán cho P2O5 hoặc H3PO4 vào dung dịch kiềm
Đặt T =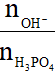
Nếu:
T ≤ 1: Tạo muối H2PO4-
T = 2: Tạo muối HPO4-
T ≥ 3: Tạo muối PO43-
1 < T < 2: Tạo hai muối H2PO4- và HPO42-
2 < T < 3: Tạo hai muối HPO42- và PO43-
CHƯƠNG III. CACBON – SILIC
Bài toán dẫn khí CO2 vào dung dịch kiềm
Đặt T =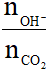
+ T ≥ 2: chỉ tạo muối trung hòa;
+ T ≤ 1: chỉ tạo muối axit;
+ 1 < T < 2: thu được cả muối trung hòa và muối axit.
Chú ý:
mbình tăng = mchất hấp thụ
Nếu sau phản ứng có kết tủa:
mdd tăng = mchất hấp thụ - mkết tủa
mdd giảm = mkết tủa – mchất hấp thụ
Xem thêm đề thi lớp 11 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 11 các môn học chuẩn khác:
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

