100+ Đề thi tuyển sinh vào lớp 10 môn Hóa Chuyên năm 2025 (cực chất) | Đề ôn thi Hóa Chuyên vào lớp 10
Bộ 100+ đề thi tuyển sinh vào lớp 10 môn Hóa học khối chuyên năm 2025 có đáp án chi tiết từ các trường Chuyên, các tỉnh trên cả nước giúp bạn có thêm tài liệu ôn thi Chuyên Hóa vào lớp 10 đạt kết quả cao.
100+ Đề thi tuyển sinh vào lớp 10 môn Hóa Chuyên năm 2025 (cực chất)
Chỉ từ 300k mua trọn bộ 94 đề thi vào 10 chuyên Hóa theo cấu trúc mới bản word có lời giải chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1053587071- NGUYEN VAN DOAN - Ngân hàng Vietcombank (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi tuyển sinh vào lớp 10 Hóa Chuyên 2025
Đề thi tuyển sinh Hóa học vào lớp 10 năm 2025 trường THPT chuyên KHTN Hà Nội
Đề thi tuyển sinh Hóa học vào lớp 10 trường Phổ thông năng khiếu HCM
Đề thi tuyển sinh Hóa học vào lớp 10 Chuyên Bạc Liêu năm 2025
Đề thi tuyển sinh vào lớp 10 Hóa Chuyên (các năm khác)
- Đề thi vào 10 chuyên Hóa tỉnh Đắk Lắk năm 2022
- Đề thi vào 10 chuyên Hóa Tp. Hà Nội năm 2022
- Đề thi vào 10 chuyên Hóa trường THPT Lê Khiết
- Đề thi vào 10 chuyên Hóa Tp. Hà Nội năm 2008
- Đề thi vào 10 chuyên Hóa tỉnh Bình Định năm 2021
- Đề thi vào 10 chuyên Hóa tỉnh Tuyên Quang năm 2021
- Đề thi vào 10 chuyên Hóa trường THPT chuyên Khoa học tự nhiên
Sở Giáo dục và Đào tạo Hà Nội
Kì thi tuyển sinh vào 10
năm 2025
Bài thi môn: Hóa học
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
Câu I (2,0 điểm
1. Nêu hiện tượmg và viết phương trình hóa học của phản ứng xảy ra trong các thí nghiệm sau:
a) Cho một đinh sắt vào dung dịch CuSO4.
b) Nhỏ vài giọt dung dịch phenolphtalein vào cốc đựng dung dịch NaOH loãng, sau đó nhỏ từ từ đến dư dung dịch vào cốc và khuấy đều.
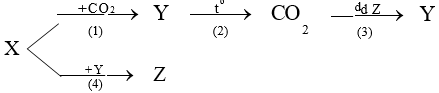
2. Cho: X là kim loại phổ biến trong vỏ trái đất và có tính nhiễm từ, Y là oxit có chứa 72,41% X
về khối lượng; và là các muối khan của . Phân tử khối của các chất , thỏa mãn điều kiện:
MY + MZ = 384 và MT – MZ = 248.
a) Xác đinh công thức hóa học của X,Y,Z,T.
b) Với các chát X,Y,Z,T ở trên, viết các phưong trình hóa học thực hiện sơ đồ chuyển hóa sau (ghi rõ điều kiện nếu có):
Câu II (2,0 điểm)
1. Để xác định xem thực vật có hô hấp hay không, một bạn học sinh đã làm thí nghiệm như sau: Cho các hạt nảy mầm vào bình được nối với ống dẫn khí như hình vẽ bên. Dẫn không khí vào ống nghiệm 1 đựng dung dịch KOH dư. Khí thoát ra khỏi ống nghiệm 1 được dẫn qua ống nghiệm 2 đựng nước vôi trong dư. Khí thoát ra khỏi ống nghiệm 2 được dẫn tiếp vào bình chứa hạt nảy mẩm. Để khí thoát ra khỏi bình chứa hạt nảy mầm một thời gian rồi mới cắm đầu ống dẫn khí vào ống nghiệm 3 đựng nước vôi trong dư. Kết thúc thí nghiệm, ở ống nghiệm 2 không có hiện tượng gi còn ở ống nghiệm 3 thấy xuất hiện vẩn đục màu trắng.
a) Giải thích vì sao phải dẫn không khí qua ống nghiệm 1 và ống nghiệm 2 trước khi dẫn vào bình chứa hạt nảy mầm.
b) Giải thích vì sao phải để khí thoát ra khỏi bình chứa hạt nảy mầm một thời gian rồi mới cắm đầu ống dẫn khí vào ống nghiệm3.
c) Dựa vào kết quả thí nghiệm trên, kết luận thực vật có hô hấp không? Từ đó cho biết có nên để nhiều chậu có ngâm hạt giống trong phòng ngủ không, vì sao?
2. Tại một phòng thí nghiêm, để kiểm tra hàm lượng hidro sunfua có trong mẩu khí lấy từ một khu dân cư, người ta cho mẫu khí đó đi vào dung dich đồng(II) sunfat dư với tốc độ 2,5 lit/ phút trong 400 phút (giả thiết chỉ có phản ứng: H2S + CuSO4 ® CuS + H2SO4, phản ứng xảy ra hoàn toàn). Lọc lấy kết tủa, làm khô thu được 1,92 mg chất rắn màu đen. Biết tại thời điểm nghiên cứu, theo tiêu chuẩn Việt Nam đối với khu dân cư, hàm lượng hiđro sunfua trong không khí không được vượt quá 0,3 mg/m3. Xác đinh hàm lượng hiđro sunfua có trong mẩu khí trên và cho biết không khí tại khu dân cư đó có bị ô nhiễm không?
Câu III (2,0 điểm).
1. Hợp chất X có công thức AB4. Tống số hạt proton, nơtron và electron trong một phân tử X là 226, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 70. Nguyên tử A có số hạt proton bằng số hạt nơtron. Nguyên tử B có tổng số hạt trong hạt nhân nhiều hơn số hạt ở lớp vỏ là 18. Xác định số hiệu nguyên tử của A,B.
2. Hấp thụ hết 4,928 gam khí CO2 bằng dung dịch chứa hỗn hợp x mol Ba(OH)2 và y mol NaOH thu được 5,91 gam kết tủa và dung dịch chỉ chứa 8,708 gam muối. Tim giá trị của và .
3. Hòa tan hoàn toàn gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 bằng 350 gam dung dịch HCl 14,6% thu được dung dịch Y. Để trung hòa lượng axit dư trong cần dùng dung dịch KOH 2M. Mặt khác, để khử hoàn toàn gam thành kim loại cần tối thiểu lit (đktc) khí CO. Tìm giá trị của V.
Câu IV (2,0 điểm)
1. Cho 22, 62 gam hỗn hợp X gồm NaOH, Na2CO3, CaCO3, Ca(OH)2 tác dụng hết với dung dịch HCl dư thu được 3,36 lit (đktc) khí CO2 và dung dịch Y. Cô cạn Y thu được 18,72 gam NaCl và m gam CaCl2 . .Viết phương trình hóa học của các phản ứng xảy ra và tìm giá trị của m.
2. Hòa tan hết m gam hỗn hợp gồm Zn, S, FeS2, FeS, Cu2S, S, MgS bằng dung dịch H2SO4 đặc, nóng thu được dung dịch Y chỉ chứa gam hỗn hợp các muối sunfat trung hòa và 8,4 lit (đktc) khí SO2 là sản phẩm khử duy nhất. Thêm từ từ dung dịch Ba(OH)2 vào thu được tối đa 33,165 gam kết tủa. Tim giá trị của .
Câu V (2,0 điểm)
1. Các chất hữu cơ X,Y,Z,T đều có công thức dạng CnH2nOn (MX = MY < MZ = MT <100). Biết:
- Chất X phản ứng được với dung dịch NaHCO3;
- Chất Y phản ứng được với dung dịch NaOH (đun nóng) nhưng không phản ứng được với Na;
- Chất Z phản ứng được với dung dịch NaOH (đun nóng) và phản ứng được với Na nhưng không phản ứng được với dung dịch NaHCO3;
- Dung dịch chất T làm đổi màu quỳ tím thành đỏ; khi T phản ứng với Na dư thì số mol H2 thu được bằng số mol T tham gia phản ứng. Xác định công thức cấu tạo của X, Y, Z, T.
2. Hỗn hợp gồm hai hiđrocacbon mạch hở có công thức CnH2n+2 và CmH2n+2; hỗn hợp gồm C2H7N và C3H9N. Trộn X với Y theo ti lệ mol tương ứng là 2 : 1 được hỗn hợp Z. Đốt cháy hoàn toàn 10,28 gam Z bằng O2 vừa đủ thu được sản phẩm cháy chỉ gồm CO2, H2O và N2. Dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư. Sau khi phản ứng xảy ra hoàn toàn thấy có khí thoát ra khỏi bình, khối lượng bình đựng nước vôi trong tăng 41,56 gam và có 56 gam kết tủa. Mặt khác, dẫn X qua dung dịch brom dư thì có tối đa 0,04 mol Br2 tham gia phản ứng và khối lượng bình brom tăng 1,12 gam. Xác định công thức phân tử của các hiđrocacbon trong X.
Cho: H = 1;C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K= 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65;Br = 80; Ba =137.
---Hết---
Sở Giáo dục và Đào tạo Quảng Ngãi
Trường THPT Lê Khiết
Kì thi tuyển sinh vào 10
năm 2025
Bài thi môn: Hóa học
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 1)
Câu I: (2,5 điểm)
I.1.(1,5 điểm)
Xác định các chất A, B, C, D và viết phương trình phản ứng thực hiện dãy chuyển hóa:
Biết A, B, C, D khi đốt đều phát ra ánh sáng màu vàng.
I.2.(1 điểm)
Nêu hiện tượng và viết phương trình phản ứng xảy ra (nếu có) khi tiến hành các thí nghiệm sau:
a/ Cho mẫu đá vôi vào dung dịch KHSO4.
b/ Sục khí Cl2 vào dung dịch FeSO4.
c/ Đun nóng tinh bột trong dung dịch H2SO4 loãng, thu được dung dịch X. Cho X vào dung dịch AgNO3 trong NH3 dư, đun nóng nhẹ.
d/ Gây nổ hỗn hợp thuốc nổ đen.
Câu II: (2 điểm)
II.1(1 điểm)
Có hỗn hợp X gồm 3 chất hữu cơ: C6H6; C2H5OH; CH3COOC2H5. Trình bày phương pháp tách riêng từng chất, viết các phương trình phản ứng xảy ra (nếu có).
II.2(1 điểm)
Chỉ dùng thêm một thuốc thử, bằng phương pháp hóa học hãy nhận biết 5 mẫu chất bột có màu tương tự nhau đựng riêng biệt trong 5 lọ mất nhãn: Ag2O, CuO, Fe3O4, MnO2, hỗn hợp (Fe và FeO). Viết phương trình phản ứng xảy ra.
Câu III: (1,5 điểm)
Dung dịch X chứa hai muối vô cơ; trong đó có chứa gốc sunfat. Cho dung dịch X tác dụng vừa đủ với dung dịch Ba(OH)2 đun nóng thu một khí A, kết tủa B và dung dịch C. Dung dịch C tác dụng với lượng dư dung dịch AgNO3 (trong môi trường HNO3) thu được kết tủa màu trắng hóa đen ngoài ánh sáng.
Kết tủa B đem nung nóng đến khối lượng không đổi được a gam chất rắn Z. Giá trị của a thay đổi tùy theo lượng Ba(OH)2 dùng. Nếu dùng Ba(OH)2 vừa đủ thì a đạt giá trị cực đại, nếu dùng Ba(OH)2 dư thì a giảm dần đến giá trị cực tiểu.
a/ Dự đoán trong dung dịch X có thể chứa những muối nào?
b/ Biết rằng khi a = 8,01 gam thì Z phản ứng vừa đủ với 50 ml dung dịch HCl 1,2M, còn lại bã rắn nặng 6,99 gam. Xác định công thức hóa học hai muối trong dung dịch X.
Câu IV: (2,5 điểm)
Dung dịch X là dung dịch HCl. Dung dịch Y là dung dịch NaOH. Cho 60 ml dung dịch X vào cốc chứa 100 gam dung dịch Y, thu dung dịch A chỉ chứa một chất tan. Cô cạn dung dịch A thu 14,175 gam chất rắn Z. Nung Z đến khối lượng không đổi thu 8,775 gam chất rắn.
a/ Tính nồng độ mol/lít của dung dịch X, nồng độ phần trăm của dung dịch Y và công thức của Z.
b/ Cho 1,64 gam hỗn hợp X1 gồm Al, Fe vào cốc đựng 84 ml dung dịch X. Sau phản ứng thêm tiếp 160 gam dung dịch Y vào cốc, phản ứng hoàn toàn, lọc lấy kết tủa, đem nung ngoài không khí đến khối lượng không đổi, thu được 1,31 gam chất rắn Y1. Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp X1.
Câu V: (1,5 điểm)
Cho etan (C2H6) đi qua xúc tác, ở nhiệt độ cao thu được một hỗn hợp khí X gồm 4 chất etan, etilen, axetilen và H2. Tỷ khối của hỗn hợp X đối với etan là 0,6. Cho 0,4 mol hỗn hợp X qua dung dịch Br2 dư, phản ứng hoàn toàn, tính số mol Br2 đã tham gia phản ứng.
(Cho: Ba = 137; S = 32; Zn = 65; N = 14; Cl = 35,5; Na = 23; O = 16; H = 1; Al = 27;Fe = 56; C = 12)
..…………. HẾT………….
Sở Giáo dục và Đào tạo Quảng Ngãi
Trường THPT Lê Khiết
Kì thi tuyển sinh vào 10
năm 2025
Bài thi môn: Hóa học
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 2)
Câu 1: (2,5 điểm)
1.1. (1,5 điểm)
Cho các muối A, B, C ứng với các gốc axit khác nhau, biết:
A + dung dịch HCl => có khí thoát ra
A + dung dịch NaOH => có khí thoát ra
B + dung dịch HCl => có khí thoát ra
B + dung dịch NaOH => có kết tủa
Ở dạng dung dịch C + A => có khí thoát ra
Ở dạng dung dịch C + B => có khí thoát ra và có kết tủa
Xác định công thức của 3 muối và viết các phương trình phản ứng xảy ra.
1.2. (1,0 điểm)
Muối X khi đốt cháy cho ngọn lửa màu vàng. Đun nóng MnO2 với hỗn hợp muối X và H2SO4 đặc tạo ra khí Y có màu vàng lục. Khí Y tác dụng với dung dịch NaOH và vôi tôi lần lượt tạo ra hai loại chất tẩy trắng A và B.
a) Xác định X, Y; gọi tên A, B và viết các phương trình phản ứng xảy ra.
b) A và B có tác dụng tẩy trắng nhờ tác dụng với CO2 của không khí. Hãy viết các phương trình hóa học để giải thích.
Câu 2: (2,0 điểm)
2.1. (1,5 điểm)
Một dung dịch gồm các chất: NaCl, Ca(HCO3)2, CaCl2, MgSO4, Na2SO4. Làm thế nào để thu được muối ăn tinh khiết từ dung dịch trên?
2.2. (0,5 điểm)
Trên bao bì của một loại phân bón NPK có kí hiệu 20.10.10
a) Nêu ý nghĩa của kí hiệu trên. Độ dinh dưỡng của phân:
- Đạm: %mN có trong phân,
- Lân: %mP2O5 tương ứng với lượng P có trong phân,
- Kali: %mK2O tương ứng với lượng K có trong phân.
b) Tính khối lượng của các nguyên tố N, P, K có trong 150 kg loại phân trên.
Câu 3: (2,0 điểm)
3.1. (1,0 điểm) Cho sơ đồ sau:
Biết: X là một chất khí, A là một polime có phân tử khối rất lớn, C phản ứng được với
kim loại Na nhưng không phản ứng với dung dịch NaOH, D phản ứng được với cả kim loại Na và dung dịch NaOH, E phản ứng được với dung dịch NaOH nhưng không phản ứng với kim loại Na.
Xác định các chất X, A, B, C, D, E và viết các phương trình phản ứng theo sơ đồ trên.
3.2. (1,0 điểm)
Hòa tan hoàn toàn 13,45 gam hỗn hợp 2 muối hiđrocacbonat và cacbonat của một kim loại kiềm bằng 300 ml dung dịch HCl 1M. Sau phản ứng, để trung hòa HCl dư thì cần 75 ml dung dịch Ca(OH)2 1M. Xác định công thức 2 muối.
Câu 4: (1,5 điểm)
Đốt cháy hoàn toàn V lít hỗn hợp khí X gồm a gam hiđrocacbon A và b gam hiđrocacbon B thu được 35,2 gam CO2 và 16,2 gam H2O. Nếu thêm vào V lít X một lượng a/2 gam A được hỗn hợp khí Y, đốt cháy hoàn toàn Y thì thu được 48,4 gam CO2 và 23,4 gam H2O. Xác định công thức phân tử của A và B, biết rằng chúng là các chất khí ở điều kiện thường.
Câu 5: (2,0 điểm)
Cho X, Y là hai dung dịch HCl có nồng độ khác nhau. Lấy V lít dung dịch X tác dụng với dung dịch AgNO3 dư thu được 35,875 gam kết tủa. Để trung hòa V’ lít dung dịch Y cần 500 ml dung dịch NaOH 0,3M.
a) Trộn V lít dung dịch X với V’ lít dung dịch Y được 2 lít dung dịch Z. Tính nồng độ mol/lít của dung dịch Z.
b) Nếu lấy 100 ml dung dịch X và 100 ml dung dịch Y lần lượt tác dụng hết với kim loại Fe thì lượng H2 thoát ra trong hai trường hợp lệch nhau 0,448 lít (đktc). Tính nồng độ mol/lít của dung dịch X và dung dịch Y.
Cho biết: H = 1, N = 14, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, S = 32, Ba = 137,
Ca = 40, C = 12, O = 16, Cl = 35,5.
------------HẾT------------
Sở Giáo dục và Đào tạo Quảng Ngãi
Trường THPT Lê Khiết
Kì thi tuyển sinh vào 10
năm 2025
Bài thi môn: Hóa học
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 3)
Câu 1: (3,0 điểm)
1.1. Trình bày hiện tượng và hoàn thành các phương trình hóa học xảy ra trong các thí nghiệm sau:
a. Cho mảnh đồng kim loại vào dung dịch H2SO4 đặc, nóng.
b. Cho hỗn hợp đồng số mol Ba và Al2O3 vào lượng nước dư.
c. Cho Fe2O3 vào dung dịch NaHSO4.
d. Cho mẫu đất đèn vào nước.
1.2. X, Y, Z là ba hóa chất được dùng phổ biến làm phân bón hóa học. Chúng là các phân bón đơn để cung cấp ba thành phần chính: đạm, lân và kali cho cây trồng. Ba hóa chất trên đều tan trong nước, biết:
X + Na2CO3tạo kết tủa trắng.
Y + NaOH tạo khí mùi khai.
Y + HCl không có hiện tượng.
Y + BaCl2 tạo kết tủa trắng.
Z + AgNO3tạo kết tủa trắng.
Z + BaCl2không có hiện tượng.
Xác định các chất X, Y, Z và hoàn thành các phương trình phản ứng trên.
1.3.Có 5 mẫu chất bột màu trắng gồm: NaCl; Na2CO3; Na2SO4; BaCO3; BaSO4. Chỉ dùng CO2 và H2O hãy phân biệt từng mẫu chất trên (các dụng cụ thí nghiệm có đủ).
Câu 2: (2,0 điểm)
2.1. Cho polime thiên nhiên R vào nước đun nóng, thấy tạo thành dung dịch keo. Nhỏ tiếp vài giọt dung dịch iot vào dung dịch keo thì không thấy hiện tượng gì, nhưng sau một thời gian thì thấy xuất hiện màu xanh. Từ chất R thực hiện dãy chuyển hóa sau:
R A B C etyl axetat.
Xác định R, A, B, C và hoàn thành các phương trình phản ứng theo sơ đồ chuyển hóa trên (mỗi mũi tên tương ứng với một phản ứng).
2.2. Cho sơ đồ chuyển hóa sau:
X Y Z Y X.
Biết: X là một phi kim; Y và Z là các hợp chất có chứa nguyên tố X. Dung dịch chất Y làm đỏ quỳ tím. Z là muối của natri, trong đó natri chiếm 39,316% về khối lượng.
Xác định các chất X, Y, Z và hoàn thành các phương trình phản ứng theo sơ đồ chuyển hóa trên (mỗi mũi tên tương ứng với một phản ứng).
Câu 3: (2,0 điểm)
H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau:
3.1.Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n.
3.2.Hấp thụ hoàn toàn m gam SO3 vào 180 gam dung dịch H2SO4 98%, thu được oleum có công thức H2SO4.3SO3. Xác định giá trị m.
Câu 4: (1,5 điểm)
Cho 6,06 gam hỗn hợp X gồm một kim loại kiềm M và một kim loại R có hóa trị III vào nước, thấy hỗn hợp X tan hoàn toàn tạo ra dung dịch A và 3,808 lít khí (đktc). Chia dung dịch A làm hai phần bằng nhau:
Cô cạn phần thứ nhất thu được 4,48 gam chất rắn khan.
Thêm V lít dung dịch HCl 1M vào phần thứ hai thấy xuất hiện 0,78 gam kết tủa.
a. Xác định tên hai kim loại và tính thành phần % khối lượng mỗi kim loại trong X.
b. Tính giá trị V.
Câu 5: (1,5 điểm)
Thực hiện phản ứng este hóa giữa axit CxHyCOOH và rượu CnH2n+1OH, sau một thời gian tách bỏ nước thì thu được hỗn hợp X gồm este, axit và rượu. Đốt cháy hoàn toàn 62 gam hỗn hợp X, thu 69,44 lít khí CO2 (đktc) và 50,4 gam H2O. Mặt khác, cho 62 gam hỗn hợp X tác dụng vừa đủ với 250 ml dung dịch NaOH 2M, sau phản ứng hoàn toàn thu được 29,6 gam rượu. Tách lấy lượng rượu rồi hóa hơi hoàn toàn thì thu được thể tích hơi đúng bằng thể tích của 11,2 gam khí nitơ đo ở cùng điều kiện nhiệt độ, áp suất.
a. Xác định công thức cấu tạo của rượu và axit.
b. Tính hiệu suất phản ứng este hóa.
Cho: C = 12; S = 32; O = 16; N = 14; H = 1; Cl = 35,5; Na = 23; K = 39; Ba = 137; Fe = 56; Zn = 65; Al = 27; Ca = 40; Cu = 64; Ag = 108.
……………. HẾT ………....
Sở Giáo dục và Đào tạo Quảng Ngãi
Trường THPT Lê Khiết
Kì thi tuyển sinh vào 10
năm 2025
Bài thi môn: Hóa học
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 4)
Câu 1: (2 điểm)
1.1. Viết phương trình hóa học của các phản ứng xảy ra ở các thí nghiệm sau:
a)Dung dịch BaCl2 + dung dịch NaHSO4 (tỉ lệ mol 1 : 1).
b)Dung dịch Ba(HCO3)2 + dung dịch KHSO4 (tỉ lệ mol 1 : 1).
c)Dung dịch Ca(H2PO4)2 + dung dịch KOH (tỉ lệ mol 1 : 1).
d)Dung dịch Ca(OH)2 + dung dịch NaHCO3 (tỉ lệ mol 1 : 1).
1.2. Cho BaO vào dung dịch H2SO4, thu được kết tủa A và dung dịch B. Thêm một lượng dư bột Al vào dung dịch B, thu được dung dịch C và khí H2 bay ra. Thêm dung dịch Na2CO3 vào dung dịch C thấy tách ra kết tủa D. Xác định A, B, C, D và viết phương trình hóa học của các phản ứng xảy ra.
Câu 2: (2 điểm)
2.1. Cho 3 hợp chất của natri là X, Y, Z có mối quan hệ sau:
Xác định công thức của X, Y, Z và viết các phương trình hóa học biểu diễn mối quan hệ trên.
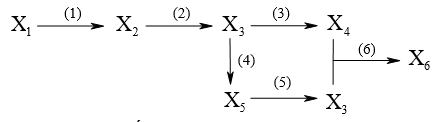
2.2. Cho sơ đồ chuyển hóa sau:
Xác định công thức các chất X1, X2, X3, X4, X5, X6 (thuộc hợp chất hữu cơ) và viết các phương trình hóa học biểu diễn chuyển hóa trên.
Câu 3: (2 điểm)
3.1. Cho 30,1 gam hỗn hợp hai kim loại gồm Al và kim loại M vào nước. Sau phản ứng chỉ thu được dung dịch B và 7,84 lít khí (đktc). Cho từ từ dung dịch HCl vào dung dịch B để thu được một lượng kết tủa lớn nhất. Lọc và cân kết tủa được 7,8 gam.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Xác định kim loại M.
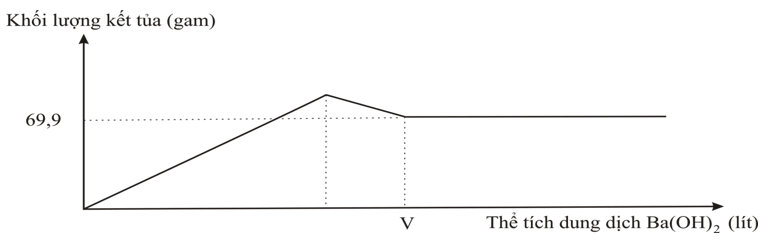
3.2. Nhỏ từ từ dung dịch Ba(OH)2 0,5M vào 400 ml dung dịch Al2(SO4)3 a M. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch Ba(OH)2 như sau:
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính a và V.
Câu 4: (2 điểm)
4.1. Hòa tan hết 5,4 gam hỗn hợp bột kim loại A hóa trị (II) và kim loại B hóa trị (III)
vào dung dịch H2SO4 loãng, thu được 10,08 lít khí H2 (đktc). Biết ,tỉ lệ số mol của 2 kim loại trong hỗn hợp là . Tìm 2 kim loại A và B.
4.2. Cho hỗn hợp X có khối lượng 31,6 gam gồm sắt và một oxit sắt hòa tan hết trong dung dịch HCl dư thu được 3,36 lít khí H2 (đktc) và dung dịch Y. Cho Y tác dụng với dung dịch NaOH dư thu được kết tủa Z. Lọc kết tủa Z rồi rửa sạch sau đó nung trong không khí đến khối lượng không đổi thu được 36 gam chất rắn.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Xác định công thức của oxit sắt.
Câu 5: (2 điểm)
5.1. Một hỗn hợp X gồm 2 hiđrocacbon A, B thuộc cùng một dãy đồng đẳng, đều ở thể khí ở đktc. Để đốt cháy hết X cần 20,16 lít O2 ở đktc, phản ứng tạo ra 7,2 gam H2O. Xác định công thức cấu tạo đúng của A, B, biết rằng khi cho lượng X trên tác dụng với dung dịch AgNO3/NH3 dư thu được 62,7 gam kết tủa (biết A, B chỉ có thể là ankan, anken, ankin).
5.2. A là hỗn hợp gồm rượu etylic và 2 axit hữu cơ kế tiếp nhau trong dãy đồng đẳng có dạng CnH2n+1COOH và Cn+1H2n+3COOH. Chia A thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với Na thấy thoát ra 3,92 lít khí H2 (đktc). Đốt cháy hoàn toàn phần 2, sản phẩm cháy dẫn qua bình 1 đựng H2SO4 đặc rồi đến bình 2 đựng dung dịch Ba(OH)2 dư thì khối lượng bình 1 tăng thêm 17,1 gam, còn bình 2 xuất hiện 147,75 gam kết tủa.
a) Xác định công thức 2 axit.
b) Tính khối lượng mỗi axit trong hỗn hợp A.
Cho: H = 1; Be = 9; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Zn = 65; Cu = 64; Ag = 108; Ba = 137.
–––––––––– HẾT ––––––––––
Phòng Giáo dục và Đào tạo .....
Đề Ôn thi vào 10
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 1)
Câu 1. (2 điểm)
1.
a/ Chất nào dùng để khắc chữ và hình trên vật liệu thủy tinh?
b/ Trước khi tiêm, thầy thuốc thường dùng bông tẩm cồn 75° xoa lên da bệnh nhân để sát trùng chỗ tiêm. Tại sao vậy?
2. “Nước đá khô” được sử dụng rộng rãi để bảo quản thực phẩm và một số loại chất kị ẩm. Giải thích tại sao?
Câu 2. (2 điểm)
1. Nêu hiện tượng và viết các Phương trình hóa học xảy ra trong các trường hợp sau:
a/ Dẫn từ từ khí CO2 đến dư vào dung dịch nước vôi trong.
b/ Nhỏ vài giọt dung dịch NaOH vào ống nghiệm chứa 1ml CuSO4. Lắc nhẹ ống nghiệm.
2. Nêu cách pha loãng H2SO4 đặc một cách an toàn. Giải thích.
Câu 3. (2 điểm)
1. Hỗn hợp A gồm Al2O3; MgO; Fe3O4; CuO. Cho luồng H2 dư qua A nung nóng được chất rắn B. Hòa tan B vào dung dịch NaOH dư thu được dung dịch C và chất rắn D. Sục khí CO2 dư vào dung dịch C và hòa tan D bằng dung dịch HNO3 loãng dư (chỉ có duy nhất khí NO bay ra). VIết các phương trình hóa học xảy ra.
2. Muối NaCl bị lẫn các tạp chất NaI; MgCl2; CaCl2; NaBr. Trình bày phương pháp hóa học để thu được NaCl nguyên chất.
Câu 4. (3 điểm)
1. Polime X chứa 38,4% cacbon; 56,8% clo và còn lại là hiđro về khối lượng. Xác định công thức phân tử, viết công thức cấu tạo của X và gọi tên, cho biết trong thực tế X dùng để làm gì?
2. Cho 6,72 lít hỗn hợp khí gồm một ankan và một olefin đi qua dung dịch brom thấy khối lượng bình brom tăng 4,2 gam và thoát ra 4,48 lít khí. Đốt cháy khí thoát ra thu được 8,96 lít khí CO2. Xác định công thức phân tử của các hiđrocacbon, biết thể tích các khí đo ở đktc.
Câu 5. (1 điểm)
Hoà tan hoàn toàn một miếng bạc kim loại vào một lượng dư dung dịch HNO3 15,75% thu được khí NO duy nhất và a gam dung dịch X; trong đó nồng độ C% của AgNO3 bằng nồng độ C% của HNO3 dư. Thêm a gam dung dịch HCl 1,46% vào dung dịch X. Hãy xác định phần trăm khối lượng AgNO3 tác dụng với HCl.
Đáp án & Thang điểm
Câu 1.
1.
a/ Axit flohiđric (HF) hòa tan dễ dàng silic đioxit (SiO2) theo phản ứng sau:
4HF (dd) + SiO2 (r) → SiF4 (k) + 2H2O
Nhờ tính chất này nên HF được dùng để khắc chữ hoặc các họa tiết trên thủy tinh. Do đó, chúng ta có thể trang trí trên thủy tinh như ý muốn.
b/ Vì cồn có khả năng thẩm thấu cao nên có thể thấm sâu vào trong tế bào vi khuẩn, gây đông tụ protein làm cho vi khuẩn chết. Tuy nhiên ở nồng độ cao sẽ làm protein trên bề mặt của vi khuẩn đông tụ nhanh tạo ra lớp màng ngăn không cho cồn thấm sâu vào bên trong, làm giảm tác dụng diệt khuẩn. Ở nồng độ thấp, khả năng động tụ protein giảm, vì vậy hiệu quả sát trùng kém. Thực nghiệm cho thấy cồn 75° có tác dụng diệt khuẩn mạnh nhất.
2.
“Nước đá khô” là CO2 ở trạng thái rắn.
Vì cacbon đioxit ở dạng rắn không nóng chảy mà thăng hoa, khi thăng hoa thu nhiệt rất lớn, làm hạ nhiệt độ của môi trường xung quanh nên tạo môi trường lạnh.
Mặt khác khi đá khô “thăng hoa” sẽ trở thành khí CO2 để bao bọc lấy thực phẩm (tạo môi trường không tồn tại sự sống quanh thực phẩm), tránh vi khuẩn, nấm mốc xâm nhập và làm hỏng thực phẩm, giúp cho thực phẩm giữ được độ tươi ngon và bảo quản được lâu.
Câu 2.
1.
a/ Hiện tượng: Xuất hiện kết tủa trắng, sau đó kết tủa tan khi CO2 dư.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3 (↓ trắng) + H2O
CaCO3 ↓ + CO2 dư + H2O → Ca(HCO3)2
b/ Hiện tượng: Xuất hiện kết tủa xanh lơ lửng trong dung dịch
Phương trình hóa học:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2 (↓ xanh)
2. H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào H2SO4 đặc nước sẽ sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm.
Vì vậy, muốn pha loãng axit sunfuric đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh và tuyệt đối không được làm ngược lại.
Câu 3.
1. Các phương trình hóa học xảy ra:
- Cho H2 dư qua A nung nóng có phản ứng:
Fe3O4 + 4H2 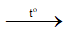
CuO + H2 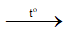
Chất rắn B gồm: Fe; Cu; Al2O3 và MgO.
- Hòa tan B bằng NaOH dư có phản ứng:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Dung dịch C gồm NaAlO2 và NaOH dư. Sục khí CO2 tới dư vào dung dịch C có các phản ứng:
CO2 + 2H2O + NaAlO2 → Al(OH)3 ↓ + NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
CO2 dư + Na2CO3 + H2O → 2NaHCO3
Chất rắn D gồm: Fe, Cu, MgO. Cho D tác dụng với HNO3 loãng dư có các phản ứng:
MgO + 2HNO3→ Mg(NO3)2 + H2O
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
2. Hòa tan hoàn toàn hỗn hợp các muối vào nước thu được dung dich.
Thêm một lượng dư Na2CO3 khi đó sẽ tách được Mg; Ca ra khỏi muối dưới dạng kết tủa:
MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Phần nước lọc còn lại gồm NaCl; NaBr; NaI. Sục khí Clo tới dư vào nước lọc và cô cạn dung dịch sẽ thu được NaCl nguyên chất.
2NaBr + Cl2→ 2NaCl + Br2
2NaI + Cl2 → 2NaCl + I2
Câu 4.
1. Đặt CTTQ của X : CxHyClz
Ta có: %H = 100% - (38,4% + 56,8%) = 4,8%
Ta có tỷ lệ:
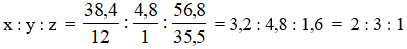
Vì X là polime nên công thức phân tử X: (C2H3Cl)n
CTCT X: 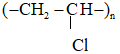
Trong thực tế PVC được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa ...
2.
Đặt CTPT của ankan là CmH2m+2 (m ≥ 1)
Đặt CTPT của olefin là CnH2n (n ≥ 2)
Khi cho hỗn hợp khí qua dung dịch brom chỉ có olefin tham gia phản ứng
CnH2n + Br2 → CnH2nBr2 (1)
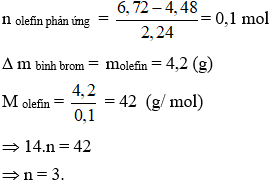
Vậy CTPT của olefin là C3H6.
Khi cho hỗn hợp qua dung dịch brom xảy ra hai trường hợp
Trường hợp 1: Brom dư khi đó khí thoát ra là ankan
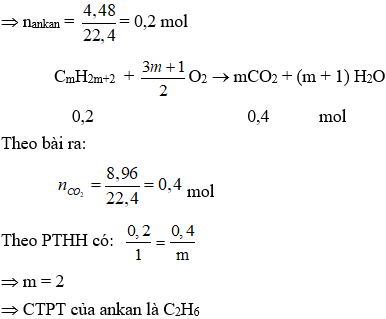
Trường hợp 2: Brom thiếu trong phản ứng (1) khi đó khí thoát ra là ankan và olefin dư
Đặt CTPT chung của 2 chất là CxHy
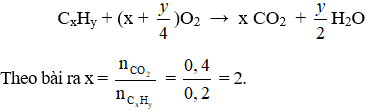
Mà n = 3 > 2 nên m < 2 ⇒ m = 1. Vậy CTPT của ankan là CH4.
Vậy CTPT của các hiđrocacbon là CH4 và C3H6 hoặc C2H6 và C3H6.
Câu 5.
* Giả sử có 63 gam dd HNO3 → nHNO3 = 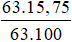
Đặt nAg phản ứng là x mol
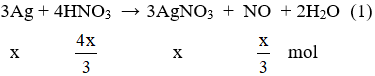
Khối lượng dung dịch sau phản ứng = 63 + 108x – 30.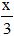
* Do C% (HNO3 dư) = C% (AgNO3) trong dd X nên:
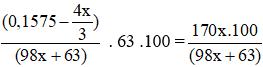
→ x = 0,039 (mol); a = 66,822 gam.
Thêm HCl vào dung dịch X:
HCl + AgNO3 → AgCl ↓ + HNO3 (2)
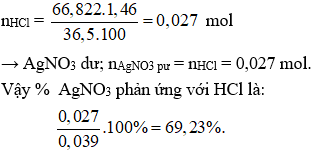
Phòng Giáo dục và Đào tạo .....
Đề Ôn thi vào 10
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 2)
Cho: Fe = 56; Zn = 65; Mg = 24; Ca = 40; Al = 27; Ga = 70; Cr = 52; Cu = 64; C = 12; O = 16; H = 1; F = 9; Cl = 35,5; Br = 80; I = 127.
Câu 1. (2 điểm)
1. Khi đốt nến (làm bằng parafin), nến chảy lỏng thấm vào bấc. Sau đó, nến lỏng chuyển thành hơi. Hơi nến cháy trong không khí tạo thành khí cacbon đioxit và hơi nước. Hãy phân tích và chỉ ra giai đoạn nào diễn ra hiện tượng vật lý, giai đoạn nào diễn ra hiện tượng hóa học. Cho biết: Trong không khí có oxi và nến cháy do có chất này tham gia.
2. Viết các phương trình hóa học xảy ra theo sơ đồ chuyển hóa sau đây
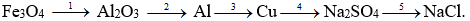
Câu 2. (2 điểm)
1. Bằng phương pháp hóa học hãy phân biệt các dung dịch: glucozơ, tinh bột, axit axetic, lòng trắng trứng chứa trong các lọ mất nhãn.
2. Nêu hiện tượng và viết các Phương trình hóa học xảy ra trong các trường hợp sau:
a) Nhỏ một vào giọt KOH vào ống nghiệm chứa 1ml FeCl3, lắc nhẹ ống nghiệm.
b) Đốt 0,5 gam photpho đỏ trong bình thủy tinh miệng rộng. Sau khi photpho cháy hết, cho 2 – 3 ml nước vào bình, đậy nút, lắc nhẹ. Thử dung dịch trong bình bằng quỳ tím.
Câu 3. (2 điểm)
Hỗn hợp X gồm 2 hiđrocacbon mạch hở là CnH2n (A) và CmH2m-2 (B). Đốt cháy hoàn toàn a gam X rồi dẫn sản phẩm cháy hấp thụ hết vào bình đựng nước vôi trong (dư) thì thấy khối lượng bình tăng 2,92 gam đồng thời tạo ra 5 gam chất kết tủa.
1. Tính a và thể tích O2 (đktc) tham gia phản ứng cháy
2. Nếu lấy 2a gam X thì có khả năng làm mất màu tối đa 60 ml dung dịch brom 1M. Xác định công thức phân tử và viết công thức cấu tạo thu gọn của A và B, biết rằng MA > MB.
Câu 4. (3 điểm) Dẫn H2 đến dư đi qua 25,6 gam hỗn hợp X gồm Fe3O4, MgO, CuO nung nóng cho đến khi phản ứng xảy ra hoàn toàn. Sau phản ứng thu được 20,8 gam chất rắn. Mặt khác 0,15 mol hỗn hợp X tác dụng vừa đủ với 225ml dung dịch HCl 2M. Hãy viết các phương trình phản ứng xảy ra và tính % số mol của mỗi chất trong hỗn hợp X.
Câu 5. (1 điểm)
1. Cho x gam một muối halogen của một kim loại kiềm tác dụng với 250 ml dung dịch H2SO4 đặc, nóng (vừa đủ) . Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp sản phẩm A trong đó có một khí B (mùi trứng thối) . Cho khí B tác dụng với dung dịch Pb(NO3)2 (dư) thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 342,4 gam chất rắn T . Nung T đến khối lượng không đổi, thu được 139,2 gam muối M duy nhất. Xác định công thức phân tử muối halogen.
2. Từ 324 kg sắn có chứa 50% tinh bột người ta sản xuất được bao nhiêu lít rượu etylic 92°. Biết rằng khối lượng riêng của rượu etylic là 0,8 gam/ml, quá trình sản xuất qua 2 phản ứng với hiệu suất lần lượt là 80% và 70%
Đáp án & Thang điểm
Câu 1.
1. Hiện tượng vật lý diễn ra ở giai đoạn nến chảy lỏng thấm vào bấc và giai đoạn nến lỏng chuyển thành hơi, trong giai đoạn này chất parafin chỉ biến đổi về trạng thái.
Hiện tượng hóa học diễn ra ở giai đoạn nến cháy trong không khí, khi đó chất parafin đã biến đổi thành chất khác.
Parafin: CnH2n+2 (n > 20)
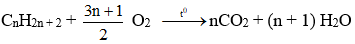
2. Các phương trình hóa học
3Fe3O4 + 8Al 
2Al2O3 
2Al + 3CuSO4 → 3Cu + Al2(SO4)3
3Cu + 2NaNO3 + 4H2SO4 → 3CuSO4 + Na2SO4 + 2NO + 4H2O
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Câu 2.
1. Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng (trích mẫu thử)
- Đun nóng nhẹ từng mẫu thử, mẫu thử nào bị đông tụ là lòng trắng trứng. Các mẫu thử còn lại không có hiện tượng đông tụ.
- Cho vào mỗi mẩu thử còn lại một mẩu quỳ tím, nếu quỳ tím chuyển sang màu đỏ là axit axetic. Còn lại tinh bột và glucozơ không làm đổi màu quỳ tím.
- Phân biệt tinh bột và glucozơ : Cho vào mỗi mẩu thử một vài giọt iot, mẫu thử nào chuyển sang màu xanh là tinh bột. Không hiện tượng xuất hiện là glucozơ.
2.
a/ Hiện tượng: Xuất hiện kết tủa màu nâu đỏ.
Phương trình hóa học:
3KOH + FeCl3 → Fe(OH)3 (↓ nâu đỏ) + 3KCl
b/ Hiện tượng: Photpho cháy trong oxi cho ngọn lửa sáng chói, có khói trắng tạo thành.
Hòa tan sản phẩm cháy vào nước, dung dịch thu được làm quỳ tím chuyển sang màu đỏ.
Phương trình hóa học:
4P + 5O2 
P2O5 + 3H2O → 2H3PO4
Dung dịch H3PO4 làm quỳ tím chuyển sang màu đỏ.
Câu 3.
1.
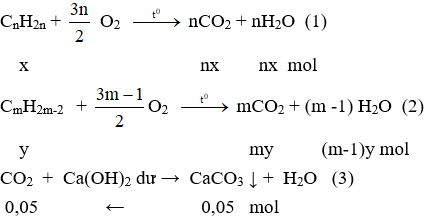
- Tính a
Theo (3) nCO2 = nCaCO3 = 5:100 = 0,05 mol
mbình tăng = mCO2 + mH2O = 2,92 (g)
→ nH2O = (2,92 - 44.0,05) : 18 = 0,04 (mol)
a = mC + mH = 12.nCO2 + 2.nH2O = 12.0,05 + 2.0,04 = 0,68 (g)
- Tính thể tích O2 tham gia phản ứng
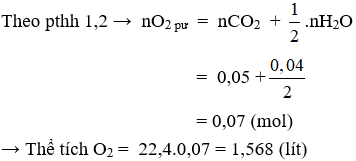
2.
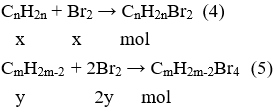
nBr2 = 0,06.1 = 0,06 (mol) ứng với 2a gam X
nBr2 ứng với a gam X = (0,06.a) : 2 = 0,03 (mol)
Trong a gam X, giả sử có x mol A và y mol B, ta có hệ phương trình:

Theo đề MA > MB ⇔ n > m (7)
Theo công thức chung cùa A và B thì n ≥ 2 và m ≥ 2 (8)
Từ (6), (7), (8) → n = 3 và m = 2 thỏa mãn.
Vậy CTPT của A là C3H6 và B là C2H2.
Câu 4.
Gọi a, b, c lần lượt là số mol các oxit Fe3O4, MgO, CuO.
mX = 25,6 gam → 232a + 40b + 80c = 25,6 (I)
Cho H2 dư đi qua hỗn hợp X, nung nóng có các Phương trình hóa học:

Chất rắn thu được sau phản ứng gồm: Fe, Cu, MgO không phản ứng.
Khối lượng chất rắn sau phản ứng là 20,8 gam → 168a + 40b + 64c = 20,8 (II)
Cho X tác dụng với HCl có phản ứng:
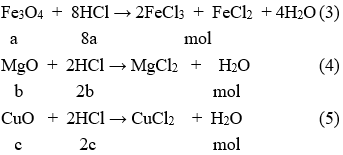
Theo bài ra ta có 0,15 mol hỗn hợp X phản ứng vừa đủ với 0,45 mol HCl
Theo Phương trình hóa học (3); (4) và (5) có (a + b + c) mol hỗn hợp X phản ứng vừa đủ với (8a + 2b + 2c) mol HCl
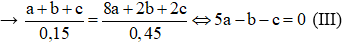
Từ (I); (II) và (III) giải hệ phương trình được: a = 0,05 mol; b = 0,15 mol và c = 0,1 mol.
% số mol từng chất trong hỗn hợp X là:
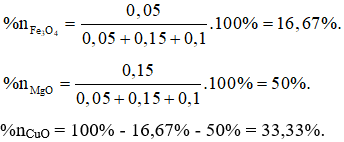
Câu 5.
1. Vì khí B có mùi trứng thối, khi tác dụng với dung dịch Pb(NO3)2 tạo kết tủa đen
⇒ B là H2S
+ Gọi công thức tổng quát của muối halogen kim loại kiềm là RX
Phương trình hóa học:
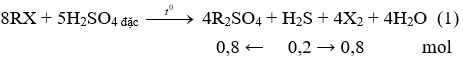
Khí B tác dụng với dung dịch Pb(NO3)2
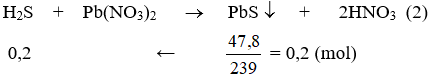
+ Sản phẩm A có: R2SO4, X2, H2O, H2S
⇒ Theo bài ra chất rắn T có: R2SO4, X2 . Khi nung T, X2 bay hơi
⇒ mR2SO4 = 139,2g.
⇒ mX2 = 342,4 – 139,2 = 203,2 (g)
Theo (1) → nX2 = 0,8(mol)

2.
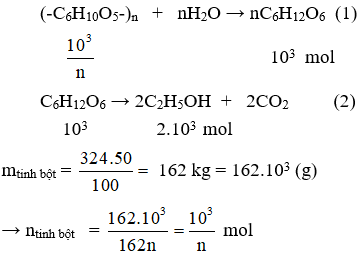
Theo các Phương trình hóa học (1) và (2) có nrượu = 2.103 mol
Mà hiệu suất cả hai quá trình phản ứng là 80% và 70% nên số mol rượu thực tế là
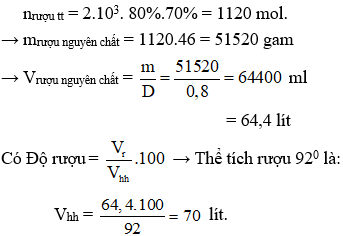
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 3)
Cho: Ca = 40, Al = 27; Fe = 56; C = 12; H = 1; O = 16; Ba = 137;
Câu 1. (2,5 điểm)
1. Chỉ được dùng một kim loại duy nhất (các dụng cụ cần thiết coi như có đủ), hãy phân biệt các dung dịch đựng trong các lọ mất nhãn sau: K2SO4, Fe(NO3)3, Al(NO3)3, NaCl.
2. Cho một luồng khí H2 (dư) lần lượt đi qua 5 ống mắc nối tiếp đựng các oxit được nung nóng (như hình vẽ):

Hãy xác định các chất trong từng ống sau thí nghiệm và viết các phương trình hóa học xảy ra.
Câu 2. (2,5 điểm)
1. Từ tinh bột và các chất vô cơ cần thiết, hãy viết các phương trình hóa học điều chế: Rượu etylic, polietilen, axit axetic, etyl axetat, metyl clorua, poli (vinyl clorua).
2. Một học sinh yêu thích môn hóa học, trong chuyến đi thăm động Thiên Cung (vịnh Hạ Long) có mang về một lọ nước (nước nhỏ từ nhũ đá trên trần động xuống). Học sinh đó đã chia lọ nước làm 3 phần và làm các thí nghiệm sau:
- Phần 1: Đun sôi
- Phần 2: Cho tác dụng với dung dịch HCl
- Phần 3: Cho tác dụng với dung dịch NaOH
Hãy nêu hiện tượng và viết các phương trình hóa học có thể xảy ra.
Câu 3. (2,5 điểm)
Hỗn hợp Z gồm một hiđrocacbon A và oxi (lượng oxi trong Z gấp đôi lượng oxi cần thiết để đốt cháy hết A). Bật tia lửa điện để đốt cháy hỗn hợp Z, đến khi kết thúc phản ứng thì thể tích khí và hơi sau khi đốt không đổi so với ban đầu. Nếu cho ngưng tụ hơi nước của hỗn hợp sau khi đốt thì thể tích giảm đi 40% (biết rằng các thể tích khí và hơi đều đo ở cùng điều kiện nhiệt độ và áp suất).
1. Xác định công thức phân tử của A.
2. Đốt cháy hoàn toàn 8,96 lít khí A (đo ở đktc) rồi cho toàn bộ sản phẩm vào dung dịch chứa 51,3 gam Ba(OH)2 thì khối lượng của dung dịch tăng hay giảm, bao nhiêu gam?
Câu 4. (2,5 điểm)
Hỗn hợp A1 gồm Al2O3 và Fe2O3. Dẫn khí CO qua 21,1 gam A1 và nung nóng thu được hỗn hợp A2 gồm 5 chất rắn và hỗn hợp khí A3. Dẫn A3 qua dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa. A2 tác dụng vừa đủ với 1 lít dung dịch H2SO4 0,5M thu được dung dịch A4 và có 2,24 lít khí thoát ra (đo ở đktc).
Tính % khối lượng mỗi chất trong hỗn hợp A1.
Đáp án & Thang điểm
Câu 1.
1. Chọn kim loại Ba để nhận biết.
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng
(trích mẫu thử)
Cho từng mẩu Ba vào các mẫu thử:
+ Mẫu nảo sủi bọt khí đồng thời tạo kết tủa trắng là K2SO4.
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
Ba(OH)2 + K2SO4 → BaSO4 (↓ trắng) + 2KOH
+ Mẫu nào sủi bọt khí đồng thời tạo kết tủa nâu đỏ là Fe(NO3)3
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
3Ba(OH)2 + 2Fe(NO3)3 → 2Fe(OH)3 (↓ nâu đỏ) + 3Ba(NO3)2
+ Mẫu nào sủi bọt khí và tạo kết tủa trắng keo, sau đó kết tủa tan là Al(NO3)3
Ba + 2H2O → Ba(OH)2 + H2 ↑
3Ba(OH)2 + 2Al(NO3)3 → 2Al(OH)3 (↓ trắng keo) + 3Ba(NO3)2
2Al(OH)3 (↓) + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+ Mẫu nào chỉ sủi bọt khí và không thấy có kết tủa là NaCl
Phương trình hóa học:
Ba + 2H2O → Ba(OH)2 + H2 ↑
2.
+ Ống 1: Không có phản ứng nên sau thí nghiệm vẫn là MgO
+ Ống 2: Có phản ứng: 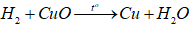
Do H2 dư nên sau thí nghiệm chất rắn trong ống 2 là Cu.
+ Ống 3: Không có phản ứng nên sau thí nghiệm vẫn là Al2O3.
+ Ống 4: Có các phản ứng:
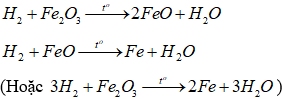
Do H2 dư nên sau thí nghiệm chất rắn trong ống 4 là Fe
+ Ống 5: Không có phản ứng nên sau thí nghiệm vẫn là Na2O.
Câu 2.
1. Các phản ứng hóa học điều chế:
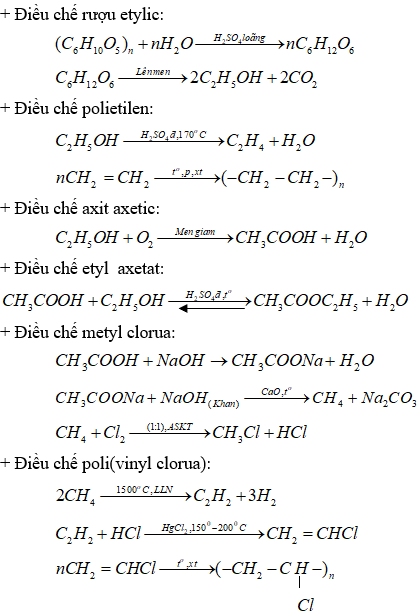
2. Lọ nước bạn học sinh mang về là dung dịch chứa chủ yếu Ca(HCO3)2
+ Phần 1: Đun sôi có cặn trắng và khí xuất hiện do phản ứng:
Ca(HCO3)2 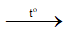
+ Phần 2: Cho tác dụng với dung dịch HCl có khí thoát ra do phản ứng:
Ca(HCO3)2 + 2HCl → CaCl2 + CO2 ↑ + 2H2O
+ Phần 3: Cho tác dụng với dung dịch NaOH có kết tủa trắng do phản ứng:
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
Câu 3.
1. Đặt công thức của A là: CxHy (ĐK: x, y thuộc N*) và thể tích của A đem đốt là a (lít), (a > 0). Phản ứng đốt cháy A.
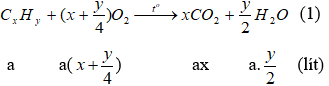
Theo giả thiết lượng oxi đã dùng gấp đôi lượng cần thiết và đến khi kết thúc phản ứng thì thể tích khí và hơi sau khi đốt không đổi so với ban đầu nên ta có phương trình:
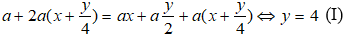
Sau khi ngưng tụ hơi nước thì thể tích giảm 40% do vậy: 
Mặt khác theo (1) thì 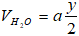
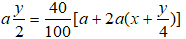
Thay (I) vào (II) ta có ⇔ x = 1 ⇒ Công thức phân tử của A là CH4.
2. 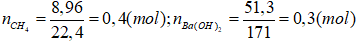
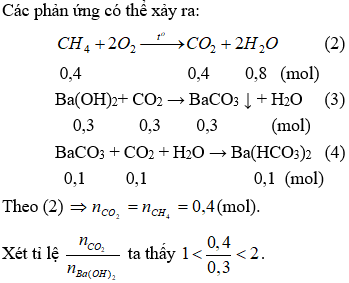
Do vậy xảy ra cả (3) và (4). Lượng BaCO3 sinh ra cực đại ở (3) sau đó hòa tan một phần theo (4).
Theo (3) nBaCO3 = nCO2 = nBa(OH)2 = 0,3 (mol)
Số mol CO2 tham gia phản ứng ở (4) là: (0,4 - 0,3) = 0,1 (mol).
Theo (4) ⇒ nBaCO3 = nCO2 = 0,1 (mol).
Vậy số mol BaCO3 không bị hòa tan sau phản ứng (4) là: nBaCO3 = 0,3-0,1 = 0,2 (mol).
Ta có: mBaCO3 - mCO2 + mH2O = 0,2.197 - (0,4.44 + 0,8.18) = 7,4 (gam)
Vậy khối lượng dung dịch giảm đi 7,4 gam.
Câu 4.
Gọi số mol của Al2O3 và Fe2O3 trong A1 lần lượt là a và b mol.
Số mol oxi nguyên tử trong A1 là: nO = 3a + 3b mol
Theo giả thiết ta tính được: nH2SO4 = 1.0,5 = 0,5(mol).
Các phản ứng có thể xảy ra:
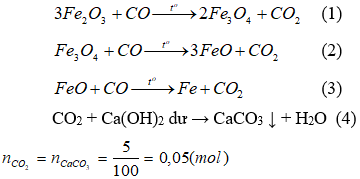
A2 gồm: Al2O3, Fe2O3, Fe3O4, FeO, Fe. Khí A3 là CO và CO2;
A2 tác dụng với dung dịch H2SO4 loãng thu được khí đó là khí H2
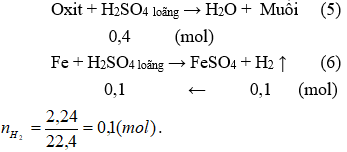
Số mol nguyên tử oxi trong A1 bằng tổng của số mol nguyên tử oxi trong A2 và số mol nguyên tử oxi chuyển từ CO thành CO2 (hay số mol CO2 ).
Mà số mol nguyên tử oxi trong A2 bằng số mol H2SO4 đã phản ứng trong (5).
→ nH2SO4 (5) = nH2SO4 (ban đầu) - nH2SO4 (6) = nH2SO4 (ban đầu) – nH2 (6)
Do vậy ta có phương trình:
3a + 3b = 0,5 - nH2 (6) + 0,05 ⇔ 3a + 3b = 0,5 – 0,1 + 0,05 = 0,45 (I)
Mặt khác: mhỗn hợp = 102a + 160b = 21,1 (II)
Giải (I) và (II) ta thu được nghiệm: a = 0,05; b = 0,1
Ghi chú: Học sinh có thể làm bằng cách khác nhưng đúng thì vẫn cho điểm tối đa.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 4)
Câu 1. (2,5 điểm)
1. Cho các chất: C6H6 (benzen) (l); CH3–CH2–CH3 (k); CH3–C≡CH (k); CH3–CH=CH2 (k); SO2 (k); CO2 (k); FeSO4 (dd); saccarozơ (dd). Chất nào có thể làm nhạt màu dung dịch nước brom, giải thích và viết phương trình phản ứng hóa học xảy ra (nếu có).
2. Viết phương trình phản ứng hóa học xảy ra (nếu có) khi tiến hành nhiệt phân lần lượt các chất rắn sau: NaNO3; KHCO3; Al(OH)3; (NH4)2SO4.
Câu 2. (2 điểm)
1. Viết công thức cấu tạo và gọi tên của tất cả các chất ứng với công thức phân tử C2H4Cl2.
2. Đốt cháy hoàn toàn 3,465gam C2H4Cl2 bằng lượng khí oxi dư, thu được hỗn hợp X (chỉ gồm CO2; O2 dư; hơi nước và khí hiđroclorua). Dẫn từ từ toàn bộ lượng X thu được vào bình kín chứa 925 gam dung dịch Ca(OH)2 0,8%, phản ứng xong thu được dung dịch Y. Tính khối lượng các chất tan có trong dung dịch Y.
Câu 3. (2 điểm)
Nhỏ từ từ dung dịch chỉ chứa chất tan KOH cho đến dư vào lần lượt từng ống nghiệm có chứa các dung dịch (riêng biệt) sau: HCl (có hòa tan một giọt phenolphtalein); MgCl2; Al(NO3)3; FeCl3; Ca(HCO3)2. Giải thích hiện tượng thu được, viết phương trình phản ứng hóa học minh họa.
Câu 4. (3 điểm)
Cho 37,95 gam hỗn hợp bột X (gồm MgCO3 và RCO3) vào cốc chứa 125,0 gam dung dịch H2SO4 a% (loãng). Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc, thu được dung dịch Y; chất rắn Z và 2,8 lít (ở đktc) khí CO2.
Cô cạn dung dịch Y được 6,0 gam muối khan, còn nung chất rắn Z tới khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2.
a. Tính: a (%); khối lượng (gam) chất rắn Z.
b. Xác định kim loại R, biết trong X số mol của RCO3 gấp 1,5 lần số mol MgCO3.
Đáp án & Thang điểm
Câu 1.
1.
+ Benzen: Brom tan trong benzen tốt hơn tan trong nước, khi cho benzen vào nước brom, benzen sẽ chiết brom từ dung môi nước sang làm cho nước brom nhạt màu (còn dung dịch benzen – brom màu sẽ đậm lên).
+ CH3–C≡CH: Có phản ứng:
CH3–C≡CH + Br2 → CH3–CBr = CHBr
(Hoặc CH3–C≡CH + 2Br2 → CH3–CBr2–CHBr2)
+ CH3–CH=CH2: Có phản ứng
CH3–CH=CH2 + Br2 → CH3–CHBr=CH2Br
+ SO2: Có phản ứng
SO2 + Br2 + H2O → 2HBr + H2SO4
+ FeSO4: Có phản ứng
6FeSO4 + 3Br2 → 2FeBr3 + 2Fe2(SO4)3
+ Các chất không làm mất màu nước brom: CO2; C3H8 và saccarozơ: vì không có phản ứng hóa học xảy ra.
2. Các Phương trình hóa học:
2NaNO3 
2KHCO3 
2Al(OH)3 
(NH4)2SO4 
Câu 2.
1. Các công thức cấu tạo và tên gọi tương ứng của chất có CTPT C2H4Cl2 là:
CH3–CHCl2 : 1,1–điclo etan
CH2Cl–CH2Cl: 1,2–điclo etan
2. 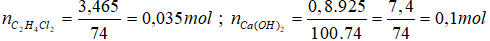
* Phương trình phản ứng cháy:
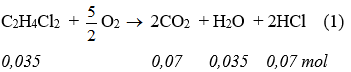
* Trật tự xảy ra phản ứng:

* Số mol Ca(OH)2 sau phản ứng với HCl = 0,1 – 0,035 = 0,065 (mol).
Ta có: 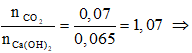
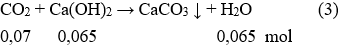
Sau phản ứng (3) CO2 dư 0,07 – 0,065 = 0,005 mol
Tiếp tục có phản ứng:
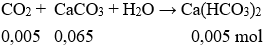
Dung dịch Y gồm các chất tan: CaCl2 0,035 mol và Ca(HCO3)2 0,005 mol
Khối lượng CaCl2 = 0,035. 111 = 3,885(gam);
Khối lượng Ca(HCO3)2 = 0,005.162 = 0,81 (gam)
Câu 3.
* dd HCl có hòa tan một giọt phenolphtalein không có màu. Khi nhỏ KOH vào dung dịch này: ban đầu không có màu (do HCl trung hòa KOH mới cho vào) sau đó dung dịch chuyển sang màu hồng (do KOH dư).
Phương trình hóa học:
KOH + HCl → KCl + H2O
* Nhỏ KOH đến dư vào dd MgCl2
Hiện tượng: xuất hiện kết tủa trắng không tan khi KOH dư.
Phương trình hóa học:
2KOH + MgCl2 → Mg(OH)2 (↓ trắng) + 2KCl
* Nhỏ KOH đến dư vào dd Al(NO3)3:
Hiện tượng: ban đầu xuất hiện kết tủa keo trắng sau đó kết tủa tan khi KOH dư.
Phương trình hóa học:
3KOH + Al(NO3)3 → Al(OH)3 (↓ keo trắng) + 3KNO3
KOH dư + Al(OH)3 ↓ → KAlO2 + 2H2O
* Nhỏ KOH đến dư vào dd FeCl3:
Hiện tượng: xuất hiện kết tủa màu đỏ nâu, kết tủa không tan khi KOH dư.
Phương trình hóa học:
3KOH + FeCl3 → Fe(OH)3 (↓ đỏ nâu) + 3KCl
* Nhỏ KOH đến dư vào dd Ca(HCO3)2:
Hiện tượng: xuất hiện kết tủa trắng, kết tủa không tan khi KOH dư.
Phương trình hóa học:
2KOH + Ca(HCO3)2 → CaCO3 (↓ trắng) + K2CO3 + 2H2O
Câu 4.
a/
- Cho X phản ứng với H2SO4 (Thí nghiệm 1)
Số mol CO2 thu được là: 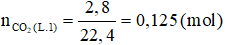
* Nung Z thu được CO2 → ở thí nghiệm 1 axit H2SO4 tham gia pư hết; X dư.
Đặt hỗn hợp X (gồm MgCO3 và RCO3) tương đương với muối MCO3.
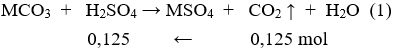
Số mol H2SO4 = số mol CO2 = 0,125 (mol)
Nồng độ % của dung dịch H2SO4 là:
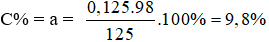
* Số mol gốc sunfat SO42- trong muối = số mol CO2;
Khối lượng SO42- trong muối = 0,125.96 = 12,0 gam > khối lượng muối rắn khan khi cô cạn dung dịch Y. Vậy trong hai muối sunfat tạo thành có 01 muối tan được trong nước (là MgSO4) và 01 muối không tan trong nước (là RSO4).
Vậy dd Y là MgSO4; Chất rắn Z là MCO3 dư và RSO4 không tan.
* Số mol MgSO4 = 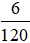
Số mol RSO4 = 0,125 – 0,05 = 0,075mol
* Chất rắn Z là MCO3 dư và RSO4 không tan; do đó:
mZ = 37,95 + 0,075(96 – 60) – 0,05.84 = 36,45(gam).
b/
mZ – mT = mCO2 = 36,45 – 30,95 = 5,5(gam).
Số mol CO2 thu được sau khi nung Z = 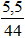
Đặt nMgCO3 = x (mol) ⇒ nRCO3 = 1,5x (mol)
Bảo toàn C: x + 1,5x = (0,125 + 0,125) = 0,25 → x = 0,1 mol
Khối lượng của RCO3 = 37,95 – 0,1.84 = 29,55 (gam)
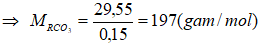
Vậy R là Ba.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Môn: Hóa học 9
Thời gian làm bài: phút
(Đề thi số 5)
Câu 1. (2 điểm)
a/ Tại sao CO2 được dùng để giập tắt đám cháy?
b/ Viết phương trình phản ứng và giải thích các hiện tượng hóa học sau:
- Trong tự nhiên có nhiều nguồn tạo ra H2S nhưng lại không có sự tích tụ H2S trong không khí.
- Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị vỡ người ta dùng bột lưu huỳnh rắc lên nhiệt kế bị vỡ.
- Trong phòng thí nghiệm bị ô nhiễm khí Cl2, để khử độc người ta xịt vào không khí dung dịch NH3.
Câu 2. (2 điểm)
1. Cho hỗn hợp X gồm Al2O3, MgO, Fe, Cu vào dung dịch HCl dư thu được dung dịch Y, khí Z và chất rắn A. Hòa tan A trong dung dịch H2SO4 đặc, nóng, dư thu được khí B. Sục từ từ khí B vào dung dịch nước vôi trong dư thu được kết tủa D. Cho từ từ dung dịch NaOH đến dư vào dung dịch Y thì thu được chất rắn E. Nung E trong không khí đến khối lượng không đổi thu được chất rắn G. Xác định thành phần các chất trong Y, Z, A, B, D, E, G. Biết các phản ứng xảy ra hoàn toàn.
2. Cho hỗn hợp khí gồm CO2, C2H4, C2H2, C2H6. Trình bày phương pháp hóa học để tách riêng từng khí ra khỏi hỗn hợp .
Câu 3. (2 điểm)
1. Cho các hóa chất và dụng cụ gồm: Canxi cacbua, nước cất, nước brom, ống nghiệm có nhánh, ống nghiệm, ống dẫn, nút cao su, ống nhỏ giọt, chậu thủy tinh, giá đỡ. Trình bày các bước tiến hành thí nghiệm, nêu hiện tượng, viết phương trình hóa học cho các thí nghiệm sau :
- Điều chế khí axetilen.
- Thu khí axetilen.
- Phản ứng cộng của axetilen.
2.
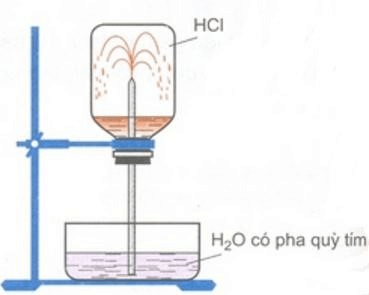
Hình trên chứng minh tính chất vật lí gì của khí hiđroclorua? Giải thích hiện tượng trên.
Câu 4. (2 điểm)
Hoà tan 34,2 gam hỗn hợp gồm Al2O3 và Fe2O3 vào trong 1 lít dung dịch HCl 2M, sau phản ứng còn dư 25% axit. Cho dung dịch tạo thành tác dụng với dung dịch NaOH 1M sao cho vừa đủ đạt kết tủa bé nhất.
1. Tính khối lượng của mỗi oxit trong hỗn hợp.
2. Tính thể tích của dung dịch NaOH 1M đã dùng.
Câu 5. (2 điểm)
Đốt cháy hoàn toàn chất hữu cơ X (MX < 78) chứa C, H, O, N thu được CO2, H2O và N2. Biết số mol H2O bằng 1,75 lần số mol CO2; tổng số mol CO2 và H2O bằng 2 lần số mol O2 tham gia phản ứng. Xác định công thức phân tử của X.
Đáp án & Thang điểm
Câu 1.
1. a
Khí CO2 nặng hơn không khí và không tác dụng với oxi nên nó có tác dụng ngăn không cho vật cháy tiếp xúc với không khí. Do đó CO2 được dùng để giập tắt các đám cháy.
Tuy nhiên với các đám cháy có kim loại mạnh (ví dụ: Mg) thì không được giập lửa bằng CO2 do sẽ làm các đám cháy trở nên nghiêm trọng hơn. Do:
2Mg + CO2 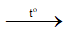
Cacbon sinh ra lại tiếp tục cháy:
C + O2 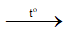
1. b
- Trong tự nhiên có nhiều nguồn tạo ra H2S nhưng lại không có sự tích tụ H2S trong không khí. Vì H2S phản ứng với O2 trong không khí ở điều kiện thường:
2H2S + O2 → 2S + 2H2O
- Trong phòng thí nghiệm, khi nhiệt kế thủy ngân bị vỡ người ta dùng bột lưu huỳnh rắc lên nhiệt kế bị vỡ. Vì Hg rất độc, lại dễ bay hơi. Trong khi đó S có thể tác dụng với Hg ở điều kiện thường tạo ra HgS không bay hơi, giúp dễ xử lý hơn.
Hg + S → HgS
- Trong phòng thí nghiệm bị ô nhiễm khí Cl2, để khử độc người ta xịt vào không khí dung dịch NH3. Do:
2NH3 + 3Cl2 → N2 + 6HCl;
NH3 (k) + HCl (k) → NH4Cl (tt)
Câu 2.
1. Các Phương trình hóa học:
Cho X vào HCl dư:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2 ↑
Dung dịch Y gồm AlCl3, MgCl2, FeCl2, HCl dư.
Khí Z là H2; Chất rắn A là Cu.
Hòa tan A bằng H2SO4 đặc, nóng, dư:
Cu + 2H2SO4 (đặc) 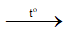
Khí B là SO2. Cho B vào nước vôi trong dư:
SO2 + Ca(OH)2 dư → CaSO3↓ + H2O
Kết tủa D là CaSO3
Cho từ từ dd NaOH đến dư vào Y
NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 ↓ + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 ↓ + 2NaCl
NaOH dư + Al(OH)3 → NaAlO2 + 2H2O
Chất rắn E là Mg(OH)2, Fe(OH)2
Nung E ta được G là MgO, Fe2O3.
4Fe(OH)2 + O2 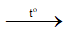
Mg(OH)2 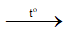
2.
- Dẫn hỗn hợp khí qua nước vôi trong dư
CO2 + Ca(OH)2 → CaCO3↓+ H2O
Lọc tách kết tủa, cho phản ứng với HCl thu lấy CO2 thoát ra:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
- Hỗn hợp khí còn lại (C2H4, C2H2, C2H6) dẫn thật chậm qua dung dịch AgNO3 / NH3 có dư :
C2H2 +2 AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
Hoặc C2H2 + Ag2O 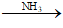
Lọc tách kết tủa rồi cho tác dụng với dung dịch HCl. Thu khí C2H2 thoát ra:
C2Ag2 + 2HCl → C2H2↑ + 2AgCl ↓
- Hỗn hợp còn lại gồm C2H4 và C2H6 cho lội chậm qua dung dịch brom (dư), C2H4 có phản ứng, bị giữ lại. Khí C2H6 không phản ứng với dung dịch brom thoát ra ngoài ,thu khí C2H6
C2H4 + Br2 → C2H4Br2
Cho bột Zn (dư) vào bình chứa dung dịch trên và đun nhẹ, thu khí C2H4
C2H4Br2 + Zn 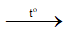
Câu 3.
1.
- Điều chế axetilen:
Cho vào ống nghiệm có nhánh 1 – 2 mẩu canxi cacbua. Đặt ống nghiệm lên giá. Đậy miệng ống nghiệm có nhánh bằng nút cao su có ống nhỏ giọt. Nhỏ từng giọt nước từ ống nhỏ giọt vào ống nghiệm, nước chảy xuống tiếp xúc với canxi cacbua, khí axetilen được tạo thành.
CaC2 + 2H2O → C2H2 ↑ + Ca(OH)2
- Thu axetilen vào ống nghiệm:
Cho đầy nước vào một ống nghiệm, úp ngược ống nghiệm vào chậu đựng nước, luồn đầu ống dẫn vào miệng ống nghiệm chứa nước. Axetilen đẩy nước trong ống nghiệm ra, khi ống nghiệm đầy khí, lấy ống nghiệm ra, dùng nút cao su đậy miệng ống nghiệm lại.
- Phản ứng cộng của axetilen:
Cho đầu thủy tinh của ống dẫn khí axetilen sục vào ống nghiệm đựng khoảng 2 ml dung dịch brom, màu của dung dịch brom nhạt dần do axetilen tác dụng với brom.
C2H2 + 2Br2 → C2H2Br4
2. Thí nghiệm trên chứng minh tính dễ tan của hiđroclorua trong nước.
Hiện tượng thí nghiệm: Nước trong chậu theo ống thủy tinh phun vào bình thành những tia nước màu đỏ.
Giải thích hiện tượng:
Khí hiđroclorua tan nhiều trong nước, tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí HCl đã hòa tan.
Dung dịch thu được là axit nên làm dung dịch quỳ tím chuyển sang màu đỏ.
Câu 4.
Gọi x; y lần lượt là số mol Al2O3 và Fe2O3 trong hỗn hợp ban đầu.
Theo bài ra: mhh = 34,2 gam → 102x + 160y = 34,2 (1)
Số mol HCl ban đầu = 2.1 = 2 mol
Số mol HCl dư = 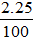
Phương trình hóa học:
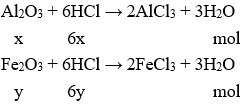
Từ 2 Phương trình hóa học suy ra: 6(x + y) = 1,5 (2)
Từ (1) và (2) suy ra x = 0,1 mol ; y = 0,15 mol
a) Khối lượng mỗi oxit trong hỗn hợp:
mAl2O3 = 0,1.102 = 10,2 gam ;
mFe2O3 = 34,2 – 10,2 = 24 gam.
b) Dung dịch sau phản ứng có chứa: AlCl3 0,2 mol; FeCl3 0,3 mol và HCl dư 0,5 mol.
Phương trình hóa học xảy ra:
HCl + NaOH → NaCl + H2O
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Để khối lượng kết tủa bé nhất thì Al(OH)3 tan hết trong NaOH, do đó kết tủa chỉ có Fe(OH)3
Từ các Phương trình hóa học trên suy ra:
Tổng số mol NaOH cần dùng = nHCl dư + 4.nAlCl3 + 3.nFeCl3
= 0,5 + 4. 0,2 + 3.0,3
= 2,2 mol
Vậy thể tích dung dịch NaOH cần dùng = 2,2/1 = 2,2 lít.
Câu 5.
Đặt CTPT X là: CxHyOzNt (giả sử: 1 mol)

Mặt khác tổng số mol CO2 và H2O bằng 2 lần số mol O2 tham gia phản ứng:
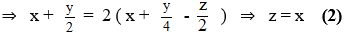
Từ (1) và (2) ⇒ x : y : z = 2:7:2
Công thức phân tử của X có dạng: (C2H7O2Nt)n
Vì MX < 78 nên ⇒ (63 + 14t).n < 78
Chỉ có n = 1 và t = 1 là thỏa mãn.
CTPT của X là : C2H7O2N
....................................
....................................
....................................
Trên đây là phần tóm tắt một số đề thi trong các bộ đề ôn thi Hóa học vào 10.
Xem thêm các đề kiểm tra, đề thi các môn học lớp 9 chọn lọc, có đáp án hay khác:
Tủ sách VIETJACK luyện thi vào 10 cho 2k10 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Đề thi các môn học lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)

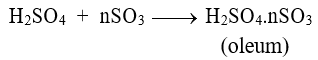



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

