Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 3 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 3: Liên kết hóa học có đáp án chi tiết đầy đủ các mức độ sẽ giúp học sinh lớp 10 ôn luyện Hóa học 10.
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 3 (có lời giải)
Chỉ từ 200k mua trọn bộ Bài tập ôn tập + Đề kiểm tra Hoá học 10 Kết nối tri thức theo Chương theo cấu trúc mới bản word có lời giải chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn.
Câu 1. Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
A. nhường 6 electron.
B. nhận 2 electron.
C. nhường 8 electron.
D. nhận 6 electron.
Câu 2. Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O.
B. CH4.
C. CH3OH.
D. NH3.
Câu 3. Tương tác van der Waals tồn tại giữa những
A. ion.
B. hạt proton.
C. hạt neutron.
D. phân tử.
Câu 4. Quá trình tạo thành ion Al3+ nào sau đây là đúng?
A. Al → Al3+ + 2e.
B. Al → Al3+ + 3e.
C. Al + 3e → Al3+.
D. Al + 2e → Al3+.
Câu 5. Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
A. cộng hóa trị có cực.
B. hydrogen.
C. cộng hóa trị không cực.
D. ion.
Câu 6. Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
A. helium.
B. argon.
C. krypton.
D. neon.
Câu 7. Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
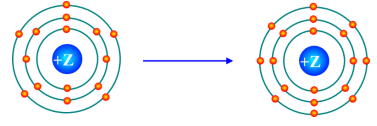
A. Aluminium
B. Nitrogen
C. Phosphorus
D. Oxygen
Câu 8. Các liên kết biểu diễn bằng dấu “•••” có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
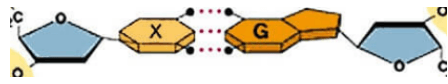
A. Liên kết ion.
B. Liên kết cộng hoá trị có cực.
C. Liên kết cộng hoá trị không cực.
D. Liên kết hydrogen.
Câu 9. Phân tử nào sau đây có các nguyên tử đều đạt cấu hình electron bão hòa theo quy tắc octet?
A. BeH2.
B. AlCl3.
C. PCl5.
D. SiH4.
Câu 10. Chọn phương án đúng để hoàn thành các câu sau:
“Khi tạo thành các hợp chất ion, … (1) … mất các electron hóa trị của chúng để tạo thành … (2) … mang điện tích dương và … (3) … nhận các electron hóa trị để tạo thành … (4) … mang điện tích âm”.
A. (1) kim loại, (2) anion, (3) phi kim, (4) cation.
B. (1) phi kim, (2) cation, (3) kim loại, (4) anion.
C. (1) kim loại, (2) ion đa nguyên tử, (3) phi kim, (4) anion
D. (1) kim loại, (2) cation, (3) phi kim, (4) anion.
Câu 11. Tính chất nào sau đây không phải tính chất của hợp chất ion?
A. Có tính bền, nhiệt độ nóng chảy cao.
B. Nhiệt độ nóng chảy, nhiệt độ sôi cao.
C. Có tính dẫn nhiệt và nhiệt độ nóng chảy thấp.
D. Chứa các liên kết ion.
Câu 12. Dãy được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử là
A. HCl, Cl2, NaCl.
B. Cl2, HCl, NaCl.
C. NaCl, Cl2, HCl.
D. Cl2, NaCl, HCl.
Câu 13. Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là
A. 1, 2, 3, 4.
B. 1, 2, 3, 1.
C. 2, 2, 2, 2.
D. 1, 2, 2, 1.
Câu 14. Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B. Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết δ.
C. Liên kết δ bền vững hơn liên kết π.
D. Có hai kiểu xen phủ chính hình thành liên kết là xen phủ trục và xen phủ bên.
Câu 15. Số liên kết σ và π có trong phân tử C2H2 lần lượt là
A. 2 và 3.
B. 3 và 1.
C. 2 và 2.
D. 3 và 2.
Câu 16. Cho các chất sau: H2O, Cl2, K2O, NaF, N2, HCl, MgO. Số chất chứa liên kết ion trong phân tử là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 17. Cho các chất sau: CO, O3, CO2, HNO3, NH4Cl, NaNO3, H2O2. Số chất có chứa liên kết cho – nhận là
A. 4.
B. 3.
C. 6.
D. 5.
Câu 18. Cho các phát biểu về các loại liên kết?
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 19. Độ âm điện của N và H tương ứng là 3,04 và 2,2.
a. Liên kết H−N là liên kết cộng hoá trị không phân cực.
b. Hợp chất NH3 có nhiệt độ nóng chảy, nhiệt độ sôi cao.
c. Cặp electron dùng chung trong liên kết H−N lệch về phía nguyên tử N.
d. NH3 là hợp chất ion.
Câu 20. Cho các nhận định sau về liên kết hóa học:
a. Các orbital p vừa có khả năng xen phủ tạo liên kết s vừa có khả năng xen phủ tạo liên kết p tuỳ thuộc vào kiểu xen phủ.
b. Liên kết cộng hoá trị không phân cực chỉ có thể tạo thành từ các nguyên tử của cùng một nguyên tố hoá học.
c. Tất cả các nguyên tử khi tham gia tạo thành liên kết cộng hoá trị đều thoả mãn quy tắc octet.
d. Hiệu độ âm điện giữa hai nguyên tử càng cao thì liên kết càng phân cực.
Câu 21. Khi đun nóng dung dịch sodium chloride bão hòa, thu được tinh thể sodium chloride khan. Sau đó, nung nóng đến khoảng 800 °C thì tinh thể sodium chloride chảy lỏng.
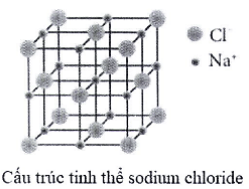
a. Quá trình hình thành tinh thể sodium chloride ở trên được gọi là sự kết tinh.
b. Quá trình hình thành tinh thể sodium chloride ở trên là quá trình sắp xếp lại các ion Na+, CL- từ chuyển động tự do thành cấu trúc có trật tự trong tinh thể.
c. Trong tinh thể sodium chloride, xung quanh 1 ion Na+ có 6 ion CL- gần nhất.
d. Tinh thể sodium chloride nóng chảy ở khoảng 800 °C, chứng tỏ lực liên kết giữa các ion trong tinh thể là yếu.
Câu 22. Liên kết được tạo nên từ sự xen phủ trục của hai AO gọi là liên kết sigma. Liên kết được tạo nên từ sự xen phủ bên của hai AO gọi là liên kết pi.
a. Các AO s chỉ có khả năng xen phủ tạo liên kết s.
b. Các AO p không có khả năng xen phủ tạo liên kết s.
c. Liên kết s bền vững hơn liên kết p.
d. Liên kết s có thể tạo thành từ sự xen phủ trục của hai AO khác loại.
Phần III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
Câu 23. Nguyên tử X có điện tích hạt nhân là +20. Khi hình thành liên kết hóa học X có xu hướng nhường đi bao nhiêu electron để đạt octet?
Câu 24. Cho các ion: Li+, Ca2+, O2-, Cl-. Số hợp chất ion (tạo nên từ một loại cation và một loại anion) từ các ion đã cho là bao nhiêu?
Câu 25. Cho các phân tử sau: NaCl, HCl, O2, N2, NH3, CO2, MgO. Có bao nhiêu phân tử có liên kết cộng hóa trị?
Câu 26. Trong công thức CS2 tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là?
Câu 27. Cho các phân tử sau: Br2, H2O, NaF và CH4.Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Câu 28. Nhiệt độ sôi của từng chất methane (CH4), ethane (C2H6), propane (C3H8) và butane (C4H10) là một trong bốn nhiệt độ sau: 0 oC; – 164 oC; – 42 oC và – 88 oC. Dựa trên kiến thức về liên kết hóa học, dự đoán nhiệt độ sôi của ethane là bao nhiêu oC?
................................
................................
................................
Xem thêm đề kiểm tra Hóa học lớp 10 Kết nối tri thức có đáp án hay khác:
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 1 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 2 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 4 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 5 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 6 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 7 (có lời giải)
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT














 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

