Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 5 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 5: Năng lượng hóa học có đáp án chi tiết đầy đủ các mức độ sẽ giúp học sinh lớp 10 ôn luyện Hóa học 10.
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 5 (có lời giải)
Chỉ từ 200k mua trọn bộ Bài tập ôn tập + Đề kiểm tra Hoá học 10 Kết nối tri thức theo Chương theo cấu trúc mới bản word có lời giải chi tiết, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn.
Câu 1. Phản ứng tỏa nhiệt là
A. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
B. phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. phản ứng không có sự giải phóng năng lượng.
D. phản ứng có ∆rH > 0.
Câu 2. Cho phương trình nhiệt hóa học của phản ứng
Cu(OH)2(s) CuO(s)+H2O(1) ∆r= ± 9,0 kJ
Phản ứng trên là phản ứng
A. tỏa nhiệt.
B. không có sự thay đổi năng lượng.
C. thu nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 3. Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
A. xảy ra phản ứng tỏa nhiệt.
B. xảy ra phản ứng thu nhiệt.
C. xảy ra phản ứng trao đổi chất với môi trường.
D. có sự giải phóng nhiệt lượng ra ngoài môi trường.
Câu 4. Biến thiên enthalpy chuẩn của phản ứng được kí hiệu là
A. ∆f.
B. ∆fH.
C. ∆r.
D. ∆rH.
Câu 5. Cho các phương trình nhiệt hóa học sau:
(1) CaCO3(s) → CaO(s) + CO2(g) ∆r= +176,0 kJ
(2) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆r= -890,0 kJ
(3) C(graphite) + O2 (g) → CO2 (g) ∆r= -393,5 kJ
(4) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) ∆r= -851,5 kJ
Số phản ứng thu nhiệt trong các phản ứng trên là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6. Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
A. Phản ứng nung vôi.
B. Phản ứng giữa H2 và O2 trong không khí.
C. Phản ứng giữa Fe và dung dịch H2SO4 loãng.
D. Phản ứng nhiệt phân thuốc tím.
Câu 7. Cho các phương trình nhiệt hóa học sau:
(1) 2NaHCO3(s)→ Na2CO3(s)+H2O(l) + CO2(g) ∆r= + 20,33 kJ
(2) 4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(l) ∆r= -1 531 kJ
Nhận xét đúng là
A. Cả hai phản ứng đều thu nhiệt.
B. Cả hai phản ứng đều tỏa nhiệt.
C. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt.
Câu 8. Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 9. Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phát biểu nào sau đây là đúng?
A. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
B. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
C. Phản ứng đốt than là phản ứng thu nhiệt, phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
D. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Câu 10. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là
A. biến thiên nhiệt lượng của phản ứng.
B. biến thiên enthalpy của phản ứng.
C. enthalpy của phản ứng.
D. biến thiên năng lượng của phản ứng.
Câu 11. Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Cồn cháy trong không khí.
B. Phản ứng tạo gỉ sắt.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng trong lò nung clinker xi măng.
Câu 12. Ở điều kiện chuẩn. Khi phản ứng thu nhiệt thì
A. ∆r> 0.
B. ∆r= 0.
C. ∆r<0.
D. ∆r≥ 0.
Câu 13. Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất được kí hiệu là
A. ∆f.
B. ∆fH.
C. ∆r.
D. ∆rH.
Câu 14. Cho phản ứng sau:
H2(g) + Cl2(g) → 2HCl (g) ∆r= -184,6 kJ
Phản ứng này là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng thế.
D. phản ứng phân hủy.
Câu 15. Cho các phát biểu sau:
(1). Tất cả các phản ứng cháy đều thu nhiệt.
(2). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(3). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(4). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Số phát biểu sai là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 16. Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 17. Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C(than chì) + O2(g) → 2CO(g)
B. C(than chì) + O(g) → CO(g)
C. C(than chì) + O2 → CO(g)
D. C(than chì) + CO2(g) → 2CO(g)
Câu 18. Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) 2NO(g) ∆r= +179,20 kJ
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt mạnh.
B. Phản ứng xảy ra thuận lợi ở điều kiện thường.
C. Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
D. Phản ứng thu nhiệt.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 19. Cho phương trình nhiệt hóa sau:
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g) ∆r= -1234,83 kJ
a. Phản ứng trên là phản ứng tỏa nhiệt.
b. Nhiệt tạo thành của O2(g) bằng 0.
c. Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy của sản phẩm.
d. Để đốt cháy 1 mol chất lỏng C2H5OH cần nhiệt lượng là 1234,83 kJ.
Câu 20. Trong y tế, nitrogen monoxide thường được biết đến là một loại khí hít được sử dụng với vai trò như một chất giảm đau và sử dụng để chăm sóc đặc biệt để thúc đẩy sự giãn nở của mao mạch và phổi. Cho phản ứng tổng hợp nitrogen monoxide từ ammonia có xúc tác plantinum như sau:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆r= -609 kJ
a. Phản ứng (1) là phản ứng thu nhiệt.
b. Phản ứng: 4NO(g)+6H2O(g) → 4NH3(g)+5O2(g) có ∆r= +609kJ.
c. Phản ứng (1) có năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm.
d. Phản ứng (1) xảy ra mạnh hơn khi tiến hành ở nhiệt độ và áp suất cao.
Câu 21. Cho sơ đồ biểu diễn biến thiên của phản ứng: CaCO3(s) → CaO(s) + CO2(g)
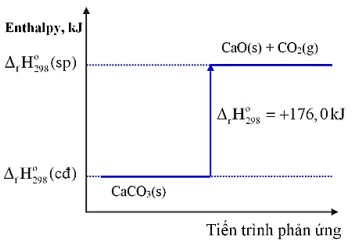
a. Phản ứng trên là phản ứng tỏa nhiệt.
b. Phản ứng hấp thụ năng lượng dưới dạng nhiệt.
c. Nhiệt tạo thành chuẩn của CaCO3(s) là 176 kJ/mol.
d. Phản ứng xảy ra thuận lợi ngay điều kiện thường.
Câu 22. Cho phương trình nhiệt hóa học sau:
H2(g) + Cl2(g) → 2HCl(g) ∆r= -186kJ.
a. Phản ứng trên gây nổ ngay trong bóng tối.
b. Khi tăng nồng độ HCl thì tốc độ phản ứng tăng.
c. Nhiệt tạo thành của HCl (g) là -93 kJ/mol.
d. Phản ứng trên là phản ứng tỏa nhiệt.
Phần III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
Câu 23. Cho phản ứng đốt cháy ethane:
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l)
Biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane là bao nhiêu kJ? (Kết quả làm tròn đến hàng đơn vị)
Biết:
|
Chất |
C2H6 (g) |
O2 (g) |
CO2 (g) |
H2O (l) |
|
∆f (kJmol-1) |
-84,7 |
0 |
-393,5 |
-285,8 |
Câu 24. Cho phản ứng sau:
CO (g) + O2 (g) →CO2 (g) ∆r= -283,0 KJ
Biết nhiệt tạo thành chuẩn của CO2: ∆r(CO2(g))= -393,5 KJ
Nhiệt tạo thành chuẩn của CO là bao nhiêu kJ/mol? Làm tròn kết quả đến hàng đơn vị.
Câu 25. Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là bao nhiêu kJ? (Làm tròn kết quả đến hàng đơn vị)
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
∆f (kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
Câu 26. Cho phản ứng sau:
H2 (g) + Cl2 (g) → 2HCl (g)
Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu kJ?
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
Câu 27. Cho phản ứng hóa học sau:
2H2(g) + O2(g) 2H2O(g)
Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu kJ?
Biết: Eb(H-H) = 432 kJ/mol; Eb(O=O) = 498 kJ/mol; Eb(O-H) = 467 kJ/mol.
Câu 28. Cho phản ứng hóa học sau:
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g)
Biến thiên enthalpy chuẩn của phản ứng là bao nhiêu kJ?
Biết: Eb(C-C) = 347 kJ/mol; Eb(C-H) = 413 kJ/mol; Eb(O=O) = 498 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(O-H) = 467 kJ/mol.
................................
................................
................................
Xem thêm đề kiểm tra Hóa học lớp 10 Kết nối tri thức có đáp án hay khác:
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 1 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 2 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 3 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 4 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 6 (có lời giải)
Đề kiểm tra Hóa học 10 Kết nối tri thức Chương 7 (có lời giải)
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Kết nối tri thức
- Giải Chuyên đề Hóa học 10 Kết nối tri thức
- Giải SBT Hóa học 10 Kết nối tri thức
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
















 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

