Bộ 4 Đề thi Hóa học 11 Giữa kì 1 có đáp án
Bộ 4 Đề thi Hóa học 11 Giữa kì 1 có đáp án
Dưới đây là danh sách Bộ 4 Đề thi Hóa học 11 Giữa kì 1 có đáp án. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi Hóa học 11.
Sở Giáo dục và Đào tạo .....
Đề thi Giữa kì 1
Môn: Hóa học 11
Thời gian làm bài: 45 phút
(Đề 1)
Câu 1: Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, PO43-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3-.
D. K+, Al3+, Cl-, CO32-.
Câu 2: Trộn các cặp chất và dung dịch sau:
(1) NaHSO4 + NaHSO3;
(2) Na3PO4 + K2SO4;
(3) AgNO3 + Fe(NO3)2;
(4) CH3COONa + H2O;
(5) CuS + HNO3 (đ, t°);
(6) Ba(OH)2 + H3PO4;
(7) Ca(HCO3)2 + NaOH;
(8) NaOH + Al(OH)3;
(9) MgSO4 + HCl.
Số phản ứng axit - bazơ xảy ra là :
A. 4.
B. 5.
C. 7.
D. 6.
Câu 3: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. CaO + CO2 → CaCO3.
B. Fe + CuCl2 → FeCl2 + Cu.
C. Ba(NO3)2 + 2NaOH → Ba(OH)2 + 2NaNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Câu 4: Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 0,5M và HNO3 0,5M vào 100 ml dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M, thu được V lít khí CO2 (ở đktc). Giá trị của V là
A. 1,12.
B. 2,24.
C. 3,36.
D. 4,48.
Câu 5: Tiến hành các thí nghiệm sau:
(1) Sục khí H2S vào dung dịch FeSO4.
(2) Sục khí H2S vào dung dịch CuSO4.
(3) Sục khí SO2 vào dung dịch NaOH dư.
(4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2.
(5) Sục H2S và dung dịch Ca(OH)2 dư.
(6) Nhỏ từ từ dung dịch K2CO3 vào dung dịch FeCl3.
(7) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(8) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Số thí nghiệm tạo ra kết tủa là
A. 4.
B. 5.
C. 6.
D. 7.
Câu 6: Chất X là muối khi tan trong nước tạo ra dung dịch có môi trường axit. Khi cho X tác dụng với dung dịch BaCl2 dư hay dung dịch KOH dư đều thu được kết tủa (sau khi phản ứng xảy ra hoàn toàn). X là
A. Al2(SO4)3.
B. ZnSO4.
C. Na2SO4.
D. CuSO4.
Câu 7: Quỳ tím hóa đỏ khi cho vào dung dịch có pH nào sau đây?
A. 7.
B. 8,5.
C. 2.
D. 9.
Câu 8: Một dung dịch có [H+] < [OH-] thì dung dịch đó có môi trường
A. axit.
B. bazơ.
C. trung tính.
D. không xác định được.
Câu 9: Dung dịch X gồm 0,15 mol K+; 0,3 mol Mg2+; 0,25 mol Na+; a mol Cl- và b mol SO42-. Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
A. 0,4.
B. 0,3.
C. 0,2.
D. 0,5.
Câu 10: Phương trình điện li nào sau đây không đúng?
A. H2SO4 → 2H+ + SO42- .
B. CH3COOH ⇌ CH3COO- + H+ .
C. HF → H+ + F-.
D. KClO → K+ + ClO- .
Câu 11: Trong số các chất sau: HNO2, CH3COOH, C6H6, HCOOH, C6H12O6, C2H5OH, NaClO, CH4, NaOH, NH4NO3 , H2S. Số chất thuộc loại chất điện li yếu là
A. 7.
B. 5.
C. 6.
D. 4.
Câu 12: Trộn 100 ml dung dịch NaOH có pH = 11 với 50 ml dung dịch KOH có pH = 12 thu được dung dịch X. Nồng độ ion OH trong dung dịch X là
A. 7.10-12 M.
B. 4,3.10-11 M.
C. 4.10-3 M.
D. 7,3.10-2 M.
Câu 13: Khi thêm một ít dung dịch HCl vào dung dịch CH3COOH thì nồng độ ion CH3COO- trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. Tăng.
B. Giảm.
C. Không đổi.
D. Tăng sau đó giảm.
Câu 14: Cho 0,266 lít dung dịch X gồm NaOH 0,5M và Ba(OH)2 0,25M vào 140 ml dung dịch Al2(SO4)3 0,3 M thu được m gam kết tủa. Giá trị của m là
A. 5,46.
B. 20,9545.
C. 34,818.
D. 15,4945.
Câu 15: Dung dịch gồm NaOH 0,2M và Ba(OH)2 0,1M có giá trị pH là
A. 13,6.
B. 0,4.
C. 0,5.
D. 13,5.
Câu 16: Cho từ từ dung dịch KHSO4 vào lượng dư dung dịch Ca(HCO3)2 thì
A. có sủi bọt khí CO2, có kết tủa trắng CaSO4, trong dung dịch có K2CO3.
B. có sủi bọt khí CO2, có kết tủa trắng CaSO4 và CaCO3, trong dung dịch có KHCO3.
C. có sủi bọt khí CO2, có kết tủa trắng CaSO4, trong dung dịch có KHCO3.
D. có sủi bọt khí CO2, có kết tủa trắng CaSO4 và CaCO3, trong dung dịch có KHSO4.
Câu 17: Trong dung dịch H3PO4 có tất cả bao nhiêu anion (bỏ qua sự phân li của nước)?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18: Cho 100ml dung dịch X chứa KOH 0,13M và Ba(OH)2 0,1M tác dụng với 200ml dung dịch H2SO4 x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
A. 0,03.
B. 0,09.
C. 0,06.
D. 0,045.
Câu 19: Dung dịch nào sau đây không dẫn điện?
A. Dung dịch HCl trong nước.
B. Dung dịch glucozơ trong nước.
C. Dung dịch NaCl trong nước.
D. Dung dịch NaOH trong nước.
Câu 20: Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Axit axetic (CH3COOH) là axit nhiều nấc.
B. Một hợp chất trong thành phần phân tử có hiđro là axit.
C. Bazơ là chất khi tan trong nước phân li ra ion OH-.
D. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
Câu 21: Có 500 ml dung dịch X chứa Na+, NH4+, CO32- và SO42-. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu được 2,24 lít khí. Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thu được 43 gam kết tủa. Lấy 200 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu được 8,96 lít khí NH3. Các phản ứng hoàn toàn, các thể tích khí đều đo ở đktc. Tổng khối lượng muối có trong 300 ml dung dịch X là
A. 71,4 gam.
B. 23,8 gam.
C. 86,2 gam.
D. 119 gam.
Câu 22: Một dung dịch có chứa các ion: NH4+ (0,1 mol), K+ (0,15 mol), NO3- (0,1 mol), và CO32- (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Câu 23: Cho các chất sau: K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Ag; Cr(OH)3; Cu(OH)2; Al; Zn; CuS. Số chất tác dụng được với HCl là
A. 8.
B. 10.
C. 9.
D. 7.
Câu 24: Cho từ từ z mol khí CO2 vào hỗn hợp A gồm x mol NaOH và y mol Ba(OH)2 thấy kết tủa xuất hiện, tăng dần đến cực đại và tan đi một phần. Sau phản ứng, thu được m gam kết tủa. Giá trị của m là
A. 197(x + 2y - z).
B. 197(x + y - z).
C. 197(z - x - 2y).
D. 197(2z - x - y).
Câu 25: Cho các phản ứng sau:
(1) (NH4)2SO4 + BaCl2 →;
(2) CuSO4 + Ba(NO3)2 →;
(3) Na2SO4 + BaCl2 →;
(4) H2SO4 + BaSO3 → ;
(5) (NH4)2SO4 + Ba(OH)2 →;
(6) Fe2(SO4)3 + Ba(NO3)2 → .
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Câu 26: Muối nào sau đây là muối axit?
A. NH4HCO3.
B. HCOONa.
C. HCOONH4.
D. (NH4)2CO3.
Câu 27: Cho hỗn hợp gồm Na và Ba tan hoàn toàn trong nước thu được dung dịch X và 1,008 lít khí H2 (ở đktc). Thể tích dung dịch chứa HCl 1M và H2SO4 1M cần dùng để trung hòa X là
A. 60ml.
B. 15ml.
C. 45ml.
D. 30ml.
Câu 28: Cho 2 phương trình ion rút gọn:
(1) M2+ + X → M + X2+;
(2) M + 2X3+ → M2+ +2X2+.
Nhận xét nào sau đây là đúng?
A. Tính khử: X > X2+ >M.
B. Tính khử: X2+ > M > X.
C. Tính oxi hóa: M2+> X3+> X2+.
D. Tính oxi hóa: X3+ > M2+ > X2+.
Câu 29: Trong số các chất sau: C2H4; CH4; C6H6; Ca(HCO3)2, H2SO4, NaClO, Ba(OH)2, CuSO4, C2H5OH, CH3COOH, C6H12O6, CuO, CH3COONa, số chất điện li là
A. 7.
B. 8.
C. 6.
D. 5.
Câu 30: Cho các dung dịch có cùng nồng độ 0,01M: Ba(OH)2 (1); H2SO4 (2); NaOH (3); Na2SO4 (4). Thứ tự giảm dần giá trị pH của các dung dịch đó là
A. (2), (4), (3), (1).
B. (1), (3), (4), (2).
C. (1), (3), (2), (4).
D. (2), (3), (4), (1).
Đáp án & Hướng dẫn giải
Câu 1. C
A sai vì 3Mg2+ + 2PO43- → Mg3(PO4)2↓
B sai vì 2Ag+ + SO42- → Ag2SO4 ↓
Ag+ + Fe2+ → Fe3+ + Ag
D sai vì 2Al3+ + 3CO32- + 3H2O → 2Al(OH)3 ↓ + 3CO2↑
Câu 2. A
Các phản ứng axit – bazơ xảy ra là:
(1) NaHSO4 + NaHSO3 → Na2SO4 + SO2↑ + H2O
(6) 3Ba(OH)2 dư + 2H3PO4 → Ba3(PO4)2 + 6H2O
(7) Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
(8) NaOH + Al(OH)3 → NaAlO2 + 2H2O.
Câu 3. D
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai vì không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Câu 4. A
Phản ứng xảy ra theo thứ tự:
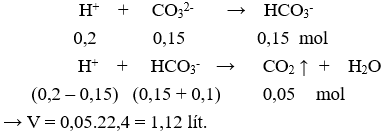
Câu 5. A
(1) H2S + FeSO4 → không phản ứng.
(2) H2S + CuSO4 → CuS↓ + H2SO4.
(3) SO2 + 2NaOH dư → Na2SO3 + H2O
(4) 2CO2 dư + Ca(OH)2 → Ca(HCO3)2.
(5) H2S + Ca(OH)2 dư → CaS + 2H2O
(6) 3K2CO3 + 2FeCl3 + 3H2O→ 2Fe(OH)3↓ + 6KCl + 3CO2↑
(7) 6NH3 dư + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
(8) Ba2+ + SO42- → BaSO4↓
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 ↓ + OH- → AlO2- + 2H2O
Vậy các thí nghiệm (2); (6); (7); (8) tạo ra kết tủa.
Câu 6. D
- Cu2+ thủy phân tạo môi trường axit.
Cu2+ + H2O → Cu(OH)+ + H+
- CuSO4 + BaCl2 → BaSO4 ↓ + CuCl2
- CuSO4 + 2KOH → Cu(OH)2 ↓ + K2SO4.
Câu 7. C
Dung dịch có môi trường axit (pH < 7) làm quỳ tím chuyển sang màu đỏ.
Câu 8. B
Dung dịch có [H+] < [OH-] thì có môi trường bazơ.
Câu 9. B
Bảo toàn điện tích có:
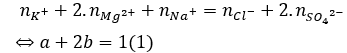
Cô cạn dung dịch X có mmuối- = ∑mion → 35,a + 96b = 43 (2)
Từ (1) và (2) có: a = 0,4 và b = 0,3.
Câu 10. C
HF ⇌ H+ + F-.
Câu 11. D
Các chất điện li yếu là: HNO2, CH3COOH, HCOOH, H2S.
Câu 12. C
pH = 11 → [OH-] = 10-3 (M)
pH = 12 → [OH-] = 10-2 (M)
Tổng số mol OH- có trong dung dịch X là: n = 0,1. 10-3 + 0,05.10-2 = 6.10-4 (mol)
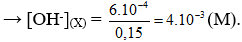
Câu 13. B
CH3COOH ⇌ CH3COO- + H+
Thêm HCl (tức thêm H+) cân bằng chuyển dịch theo chiều nghịch (chiều làm giảm nồng độ ion CH3COO-).
Câu 14. B
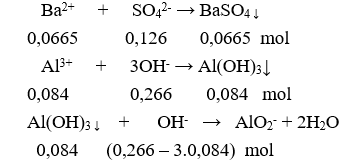
Kết tủa sau phản ứng gồm:
BaSO4: 0,0665 mol và Al(OH)3: 0,084 – 0,014 = 0,07 mol.
m = 0,0665.233 + 0,07.78 = 20,9545 gam.
Câu 15. A
∑[OH-] = 0,2 + 0,1.2 = 0,4 (M)
pOH = -log[OH-] = 0,4 → pH = 14 – pOH = 13,6.
Câu 16. C
2KHSO4 + Ca(HCO3)2 → K2SO4 + CaSO4 ↓ + 2CO2↑ + 2H2O
Do Ca(HCO3)2 dư, tiếp tục có phản ứng:
Ca(HCO3)2 + K2SO4 → CaSO4 ↓ + 2KHCO3.
Vậy kết thúc thí nghiệm có sủi bọt khí CO2, có kết tủa trắng CaSO4 và trong dung dịch có KHCO3.
Câu 17. C
H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H+ + HPO42-
HPO42- ⇌ H+ + PO43-
Bỏ qua sự phân li của nước trong dung dịch có 3 anion là: H2PO4-, HPO42-, PO43-.
Câu 18. B
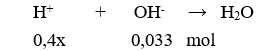
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H+ dư
→ 0,4x – 0,033 = 10-2.0,3 → x = 0,09.
Câu 19. B
Glucozơ trong nước không phân li ra ion nên không dẫn điện.
Câu 20. C
Câu 21. A
Gọi số mol Na+, NH4+, CO32- và SO42- trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
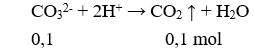
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
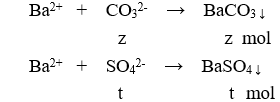
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
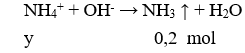
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.
Câu 22. B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
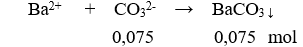
m↓ = 0,075.197 = 14,775 gam.
Câu 23. C
Các chất tác dụng với HCl là K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Cr(OH)3; Cu(OH)2; Al; Zn;
Câu 24. A
nOH- = x + 2y (mol)
Theo bài ra:
CO2 + 2OH- → CO32- + H2O
CO2 + OH- → HCO3-
Ba2+ + CO32- → BaCO3 ↓
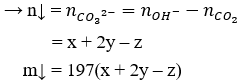
Câu 25. A
(1), (2), (3), (6) có cùng phương trình ion rút gọn là:
Ba2+ + SO42- → BaSO4 ↓
Câu 26. A
Muối axit là muối mà gốc axit vẫn còn Hiđro có thể phân li ra ion H+.
→ NH4HCO3 là muối axit.
Câu 27. D
Ta có: nOH- = 2.nkhí = nH+
→ 2.0,045 = 3V → V = 0,03 lít = 30 ml.
Câu 28. D
Theo (1) có tính oxi hóa M2+ > X2+.
Theo (2) có tính oxi hóa X3+ > M2+.
Vậy tính oxi hóa: X3+ > M2+ > X2+.
Câu 29. A
Các chất điện li là: Ca(HCO3)2, H2SO4, NaClO, Ba(OH)2, CuSO4, CH3COOH, CH3COONa.
Câu 30. B
Thứ tự giảm dần pH:
Ba(OH)2 (pH = 12,3) > NaOH (pH = 12) > Na2SO4 (pH = 7) > H2SO4 (pH = 1,7).
Sở Giáo dục và Đào tạo .....
Đề thi Giữa kì 1
Môn: Hóa học 11
Thời gian làm bài: 45 phút
(Đề 2)
Câu 1. Hòa tan m gam hỗn hợp X gồm hai muối vào nước thu được dung dịch chứa 0,05 mol Na+; 0,1 mol Mg2+; 0,2 mol Cl- và x mol SO42-. Giá trị của m là
A. 29,85.
B. 23,7.
C. 16,6.
D. 13,05.
Câu 2. Cho 4 dung dịch loãng, có cùng nồng độ mol: C2H5COOH, HCl, NH3, Ba(OH)2. Dung dịch có pH nhỏ nhất và lớn nhất lần lượt là
A. HCl và NH3.
B. CH3COOH và Ba(OH)2.
C. HCl và Ba(OH)2.
D. CH3COOH và NH3.
Câu 3. Dung dịch X chứa 0,07 mol H+; a mol Al3+; 0,12 mol NO3- và 0,02 mol SO42-. Cho 120 ml dung dịch hỗn hợp KOH 1,2M và Ba(OH)2 0,1M vào X, sau khi các phản ứng kết thúc, thu được m gam kết tủa. Giá trị của m là
A. 5,835.
B. 5,055.
C. 4,275.
D. 4,512.
Câu 4. Dung dịch nào sau đây không dẫn điện?
A. Dung dịch NaCl trong nước.
B. Dung dịch C2H5OH trong nước.
C. Dung dịch KCl trong nước.
D. Dung dịch H2SO4 trong nước.
Câu 5. Cho 4,48 lít CO2 vào 150 ml dung dịch Ca(OH)2 1M, cô cạn hỗn hợp các chất sau phản ứng ta thu được chất rắn có khối lượng là
A. 18,1 gam.
B. 15 gam.
C. 8,4 gam.
D. 20 gam.
Câu 6. Hỗn hợp X gồm (NH4)2SO4 và Na2CO3. Cho 2,91 gam X tác dụng với dung dịch BaCl2 dư thu được 5,285 gam kết tủa. Cho 2,91 gam X tác dụng với dung dịch KOH dư, thì số mol KOH đã phản ứng là
A. 0,030 mol.
B. 0,015 mol.
C. 0,020 mol.
D. 0,025 mol.
Câu 7. Trị số pH của dung dịch HCl 0,0005M là
A. 2,4.
B. 3,1.
C. 1,68.
D. 3,3.
Câu 8. Dãy nào sau đây gồm các ion cùng tồn tại trong một dung dịch?
A. NH4+, Al3+, NO3-, Cl-.
B. K+, Ca2+, Cl-, CO32-.
C. K+, Na+, OH-, HCO3-.
D. Mg2+, PO43-, OH-, Ca2+.
Câu 9. Phản ứng trao đổi ion trong dung dịch các chất điện li thực chất là phản ứng giữa các
A. nguyên tử.
B. ion.
C. tinh thể.
D. phân tử.
Câu 10. Dung dịch nào sau đây có môi trường kiềm?
A. Dung dịch có [H+] = 10-11M.
B. Dung dịch có [H+] = 10-7M.
C. Dung dịch có [OH-] = 10-7M.
D. Dung dịch có [OH-] = 10-11M.
Câu 11. Thí nghiệm nào sau đây có sinh ra chất khí nhưng không sinh ra chất kết tủa?
A. Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
B. Cho dung dịch FeCl3 vào dung dịch NH3.
C. Cho dung dịch (NH4)2CO3 vào dung dịch Ca(OH)2.
D. Cho dung dịch HCl vào dung dịch NH4HCO3.
Câu 12. Phản ứng nào sau đây có phương trình ion rút gọn là: S2- + 2H+ → H2S?
A. Na2S + 2HCl → 2NaCl + H2S.
B. Na2S + 2CH3COOH → 2CH3COONa + H2S.
C. FeS + 2HCl → FeCl2 + H2S.
D. FeS + H2SO4→ FeSO4 + H2S.
Câu 13. Dung dịch nào sau đây làm quỳ tím hóa đỏ?
A. Dung dịch có pH = 8.
B. Dung dịch có pH = 10.
C. Dung dịch có pH = 4.
D. Dung dịch có pH = 7.
Câu 14. Cho từ từ 65 ml dung dịch HCl 1,6M vào 70 ml dung dịch Na2CO3 0,8M, sau khi các phản ứng kết thúc thu được V lít khí (đktc). Giá trị của V là
A. 0,2668.
B. 0,9408.
C. 1,0752.
D. 0,8064.
Câu 15. Trong số các muối sau: KHSO4, CH3COONa, NH4Cl, Ca3(PO4)2, số muối axit là
A. 3.
B. 1.
C. 2.
D. 4.
Câu 16. Trong các dung dịch, chất nào sau đây có phản ứng với NaHCO3?
A. KOH.
B. NaCl.
C. KNO3.
D. Na2SO4.
Câu 17. Cho từ từ đến hết 140 ml dung dịch NaOH 0,6M vào 90 ml dung dịch AlCl3 0,3M. Khối lượng kết tủa thu được là
A. 0,936 gam.
B. 1,560 gam.
C. 1,872 gam.
D. 1,404 gam.
Câu 18. Phản ứng xảy ra trong dung dịch giữa cặp chất nào sau đây là phản ứng trao đổi ion?
A. BaCl2 + K2SO4.
B. SO2 + H2S.
C. Cu + H2SO4 đặc.
D. Fe + HCl.
Câu 19. Phương trình điện li nào dưới đây được viết đúng ?
A. H2SO4 ⇌ H+ + HSO4- .
B. H2CO3 ⇌ H+ + HCO3-.
C. H2SO3 → 2H+ + SO32-.
D. Na2S ⇌ 2Na+ + S2-.
Câu 20. Có 4 dung dịch: NaOH, NaCl, CH3COOH, Na2SO4 đều có nồng độ 0,1M. Dung dịch có tổng nồng độ mol của các ion nhỏ nhất là
A. NaCl.
B. NaOH.
C. CH3COOH.
D. Na2SO4.
Câu 21. Hòa tan một ít tinh thể CH3COOK vào dung dịch CH3COOH thì nồng độ H+ trong dung dịch thu được sẽ thay đổi như thế nào so với dung dịch ban đầu?
A. tăng.
B. tăng sau đó giảm.
C. không đổi.
D. giảm.
Câu 22. NH3 thể hiện tính khử khi tác dụng với chất X và thể hiện tính bazơ khi tác dụng với chất Y. Các chất X, Y tương ứng là
A. O2, HCl.
B. HCl, O2.
C. H2O, ZnCl2.
D. ZnCl2, H2O.
Câu 23. Hiđroxit nào sau đây là hiđroxit lưỡng tính?
A. Fe(OH)3.
B. Zn(OH)2.
C. KOH.
D. Ba(OH)2.
Câu 24. Dãy chất nào sau đây, trong nước đều là chất điện li yếu ?
A. H2S, HCl, NH3.
B. CuCl2, HCOOH, Ba(OH)2.
C. H2S, CH3COOH, H3PO4.
D. NaCl, H2SO3, Al2(SO4)3.
Câu 25. Trộn 80 ml dung dịch HCl 0,03M với 50 ml dung dịch H2SO4 0,02M thu được dung dịch có pH = x. Giá trị của x gần nhất với giá trị nào sau đây?
A. 1,6.
B. 1,5.
C. 2,0.
D. 1,8.
Câu 26. Cho 150 ml dung dịch CuSO4 0,1M vào 30 ml dung dịch hỗn hợp NaOH 0,2M và Ba(OH)2 0,1M, sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 0,699.
B. 1,287.
C. 4,083.
D. 2,169.
Câu 27. Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Axit càng nhiều H thì càng mạnh.
C. Bazơ mạnh là bazơ nhiều nấc.
D. Bazơ là chất khi tan trong nước phân li ra anion OH-.
Câu 28. Trộn ba dung dịch: HCl 0,2M; H2SO4 0,1M và HNO3 0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH = x. Giá trị của x là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 29. Trong số các chất sau: Cu(OH)2, Ba(NO3)2, HClO2, H2S, chất điện li mạnh là
A. HClO2.
B. H2S.
C. Ba(NO3)2.
D. Cu(OH)2.
Câu 30. Cặp chất nào sau đây vừa tác dụng với dung dịch HCl, vừa tác dụng với dung dịch NaOH?
A. Zn(OH)2, NaHCO3.
B. Al(OH)3, NH4HSO4.
C. KAlO2, (NH4)2CO3.
D. NH4Cl, NaHS.
Đáp án & Hướng dẫn giải
Câu 1. D
Bảo toàn điện tích có: 0,05 + 0,1.2 = 0,2 + 2x → x = 0,025.
mmuối = ∑mion = 0,05.23 + 0,1.24 + 0,2.35,5 + 0,025.96 = 13,05 (gam).
Câu 2. C
Axit càng mạnh thì pH càng nhỏ → HCl có pH nhỏ nhất.
Bazơ càng mạnh thì pH càng lớn → Ba(OH)2 có pH lớn nhất.
Câu 3. D
Bảo toàn điện tích có: 0,07 + 3a = 0,12 + 0,02.2 → a = 0,03 mol
Cho X vào hỗn hợp KOH và Ba(OH)2:
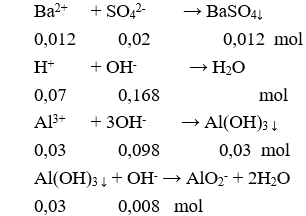
Sau phản ứng thu được kết tủa là:
BaSO4 0,012 (mol) và Al(OH)3: 0,03 – 0,008 = 0,022 (mol).
m↓ = 0,012.233 + 0,022.78 = 4,512 gam.
Câu 4. B
C2H5OH trong nước không phân li ra ion nên không dẫn điện.
Câu 5. B
Ta có: 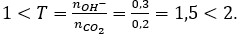
Sau phản ứng thu được các muối CaCO3: x mol và Ca(HCO3)2 y mol.
Bảo toàn C có: x + 2y = 0,2 (1)
Bảo toàn Ca có: x + y = 0,15 (2)
Từ (1) và (2) có x = 0,1 và y = 0,05.
Cô cạn hỗn hợp phản ứng:
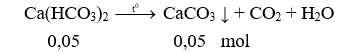
Chất rắn sau phản ứng là CaCO3 (0,1 + 0,05 = 0,15 mol)
mcr = 0,15.100 = 15 gam.
Câu 6. C
Gọi số mol (NH4)2SO4 và Na2CO3 lần lượt là x và y mol
mX = 2,91 (gam) → 132x + 106y = 2,91(1)
Cho X tác dụng với BaCl2 dư:
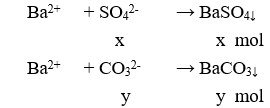
m↓ = 5,285 gam → 233x + 197y = 5,285 (2)
Từ (1) và (2) có x = 0,01 và y = 0,015.
Cho X tác dụng với KOH dư:
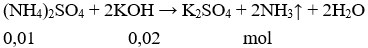
Vậy số mol KOH đã phản ứng là 0,02 mol.
Câu 7. D
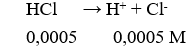
pH = -log[H+] = 3,3.
Câu 8. A
B sai do Ca2+ + CO32- → CaCO3↓
C sai do OH- + HCO3- → CO32- + H2O
D sai do 3Mg2+ + 2PO43- → Mg3(PO4)2↓
3Ca2+ + 2PO43- → Ca3(PO4)2↓
Câu 9. B
Câu 10. A
[H+] = 10-11M < 10-7 M: môi trường kiềm.
Câu 11. D
HCl + NH4HCO3 → NH4Cl + CO2↑ + H2O.
Câu 12. A
PT ion rút gọn:
A. S2- + 2H+ → H2S.
B. S2- + 2CH3COOH → 2CH3COO- + H2S.
C và D. FeS + 2H+ → Fe2+ + H2S.
Câu 13. C
Dung dịch có pH = 4 < 7: môi trường axit, làm quỳ tím chuyển sang màu đỏ.
Câu 14. C
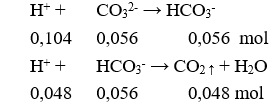
Vkhí = 0,048.22,4 = 1,0752 lít.
Câu 15. B
Muối axit là muối mà gốc axit vẫn còn hiđro phân li ra H+.
Vậy muối axit là KHSO4.
Câu 16. A
2NaHCO3 + 2KOH → K2CO3 + Na2CO3 + 2H2O
Câu 17. C
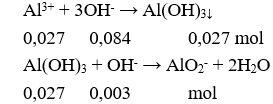
m↓ = (0,027 – 0,003).78 = 1,872 gam.
Câu 18. A
BaCl2 + K2SO4 → BaSO4 ↓ + 2KCl
B, C, D sai vì là phản ứng oxi hóa – khử.
Câu 19. B
A và D sai vì H2SO4 và Na2S là các chất điện li mạnh.
C sai vì H2SO3 là chất điện li yếu.
Câu 20. C
Trong các chất trên chỉ có CH3COOH là chất điện li yếu nên có tổng nồng độ mol của các ion là nhỏ nhất.
Câu 21. D
CH3COOH ⇌ CH3COO- + H+
Thêm CH3COOK (tức thêm CH3COO-) cân bằng chuyển dịch theo chiều nghịch (tức chiều giảm [H+]).
Câu 22. A
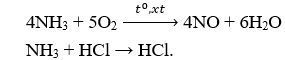
Câu 23. B
Zn(OH)2 là hiđroxit lưỡng tính.
Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ ZnO22- + 2H+.
Câu 24. C
H2S, CH3COOH, H3PO4 là các axit yếu nên là các chất điện li yếu.
Câu 25. B
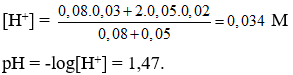
Câu 26. B
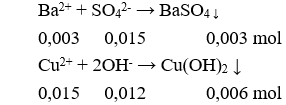
Khối lượng kết tủa là: m = 0,003.233 + 0,006.98 = 1,287 gam.
Câu 27. D
Câu 28. D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ nH+ = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
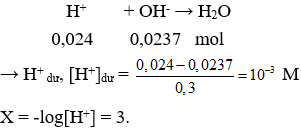
Câu 29. C
Ba(NO3)2 là muối tan nên là chất điện li mạnh.
Câu 30. A
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2o.
Sở Giáo dục và Đào tạo .....
Đề thi Giữa kì 1
Môn: Hóa học 11
Thời gian làm bài: 45 phút
(Đề 3)
Cho biết: Al = 27; S = 32; O = 16; Cl = 35,5; H = 1, K = 39, Cu = 64; Fe = 56.
Phần I: Trắc nghiệm
Câu 1. Chất không phân li ra ion khi hòa tan trong nước là
A. CaCl2.
B. HClO.
C. Ca(OH)2.
D. C2H5OH.
Câu 2. Hợp chất thuộc loại chất điện li mạnh là
A. CH3COOCH3.
B. C2H5OH.
C. H2O.
D. KCl.
Câu 3. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 4. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 5. Để phân biệt dung dịch NH4Cl và dung dịch CuCl2 ta dùng dung dịch
A. HCl.
B. H2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 7. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 8. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 9. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
C. [H+] > [NO3-].
B. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 10. Trong dung dịch NH3 (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NH2-.
B. NH4+, OH-, H2O.
C. NH4+, OH-, NH3, H2O.
D. H+, OH-, NH3, H2O.
Câu 11. Dung dịch Ba(OH)2 có pH = 13 thì nồng độ của Ba(OH)2 là
A. 0,05M.
B. 0,1M.
C. 0,01M.
D. 0,005M.
Câu 12. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 13. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 14. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 15. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 16: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. BaO + CO2 → BaCO3.
B. Zn + CuCl2 → ZnCl2 + Cu.
C. Ba(NO3)2 + 2KOH → Ba(OH)2 + 2KNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Phần II: Tự luận
Câu 1. (2 điểm) Viết phương trình điện li của các chất sau trong dung môi nước:
a. Ba(OH)2
b. CH3COOH
c. K2S
d. Zn(OH)2.
Câu 2. (2 điểm) Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau:
a. Ba(OH)2 + HCl →
b. CaCO3 + HNO3 →
Câu 3. (4 điểm) Dung dịch A có chứa: 0,01 mol M2+ ; 0,02 mol Al3+; 0,03 mol HCO32- và x mol Cl-. Khi cô cạn dung dịch A thu được 4,77 gam chất rắn khan.
a. Xác định giá trị của x và nguyên tố M.
b. Cho 300 ml dung dịch KOH 0,3M vào dung dịch A thu được m gam các chất kết tủa và dung dịch B. Xác định giá trị của m.
c. Nếu cô cạn dung dịch B sẽ thu được bao nhiêu gam chất rắn khan?
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. C
C2H5OH không phân li ra ion khi hòa tan trong nước.
Câu 2. D
KCl là muối tan nên là chất điện li mạnh.
Câu 3. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3- ⇌ H+ + CO32-.
Câu 4. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 5. D
NH4+ + OH- → NH3↑ + H2O
Cu2+ + 2OH- → Cu(OH)2↓
Câu 6. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 7. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 8. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 9. A
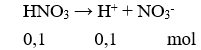
Câu 10. C
NH3 + H2O ⇌ NH4+ + OH
Câu 11. A
[H+] = 10-13 → [OH-] = 0,1 (M).
Nồng độ của Ba(OH)2 là 0,05 (M)
Câu 12. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 13. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 14. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 15. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 16. D
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4↓
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai do không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Phần II: Tự luận
Câu 1.
a. Ba(OH)2 → Ba2+ + 2OH-
b. CH3COOH ⇌ CH3COO- + H+
c. K2S → 2K+ + S2-
d. Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ ZnO22- + 2H+.
Câu 2.
a. Ba(OH)2 + 2HCl → BaCl2 + 2H2O
PT ion rút gọn: H+ + OH- → H2O
b. CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 ↑ + H2O
PT ion rút gọn:
CaCO3 + 2H+ → Ca2+ + CO2 + H2O.
Câu 3.
a. Bảo toàn điện tích có: 0,01.2 + 0,02.3 = 0,03.2 + x
→ x = 0,02 (mol).
Bảo toàn khối lượng có:
mmuối = ∑mion → 0,01.MM + 0,02.27 + 0,03.96 + 0,02.35,5 = 4,77
→ MM = 64. Vậy kim loại M là Cu.
b. Cho KOH vào dung dịch A có các phản ứng:

Vậy kết tủa sau phản ứng gồm: Cu(OH)2: 0,01 mol và Al(OH)3: 0,01 mol
m = 0,01.98 + 0,01.78 = 1,76 gam.
c. Dung dịch B gồm:
SO42-: 0,03 mol; Cl-: 0,02 mol; AlO2-: 0,01 mol và K+: 0,09 mol.
Cô cạn dung dịch B được chất rắn có khối lượng:
m = 0,03.96 + 0,02.35,5 + 0,01.59 + 0,09.39 = 7,69 gam.
Sở Giáo dục và Đào tạo .....
Đề thi Giữa kì 1
Môn: Hóa học 11
Thời gian làm bài: 45 phút
(Đề 4)
Phần I: Trắc nghiệm
Câu 1. Phản ứng nào sau đây không xảy ra?
A. NaOH + HCl.
B. KOH + NaCl
C. NaOH + Cl2.
D. NaOH + Zn(OH)2.
Câu 2. pH của dung dịch KOH 0,01M là
A. 8.
B. 12.
C. 11.
D. 9.
Câu 3. Trộn hai thể tích bằng nhau của dung dịch HNO3 và dung dịch NaOH có cùng nồng độ mol/l. Giá trị pH của dung dịch sau phản ứng là
A. pH = 2.
B. pH = 7.
C. pH > 7.
D. pH < 7.
Câu 4. Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] < 0,10M.
B. [H+] = 0,10M.
C. [H+] < [CH3COO-].
D. [H+] > [CH3COO-].
Câu 5. Cho 5g NaCl vào dung dịch chứa 8,5g AgNO3 thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu 6. Chất nào sau đây là chất điện li mạnh
A. KClO4.
B. HCl.
C. KOH.
D. Cả A,B,C.
Câu 7. Theo A-rê-ni-ut, axit là
A. chất khi tan trong nước phân li ra anion H+.
B. chất khi tan trong nước phân li ra cation H+.
C. chất khi tan trong nước phân li ra anion OH-.
D. Tất cả đều sai.
Câu 8. Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd Ba(OH)2 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu 9. Chất nào sau đây là axit theo a – rê – ni – uyt?
A. HClO.
B. CsOH.
C. NH4Cl.
D. CH3COONa.
Câu 10. Ở 25°C, tích số K = [H+].[OH-] = 1,0.10-14 được gọi là
A. tích số tan của nước.
B. tích số phân li của nước.
C. độ điện li của nước .
D. tích số ion của nước.
Câu 11. Cụm từ nào sau đây còn thiếu trong dấu “…” ở câu sau: “Các dung dịch axit, bazơ, muối dẫn điện được là do trong dung dịch của chúng có các … chuyển động tự do”.
A. electron.
B. phân tử.
C. ion.
D. nguyên tử.
Câu 12. Phương trình ion rút gọn của phản ứng cho biết:
A. Không tồn tại phân tử trong dung dịch các chất điện li.
B. Nồng độ các trong dung dịch.
C. Các ion tồn tại trong dung dịch.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. Một dung dịch có pH = 3. Nống độ ion H+ là
A. 0,003.
B. 0,01.
C. 0,1.
D. 0,001.
Câu 14. Chất nào sau đây không dẫn được điện?
A. NaCl nóng chảy.
B. CaCl2 nóng chảy.
C. HBr hoà tan trong H2O.
D. NaCl rắn, khan.
Câu 15. Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính?
A. Al(OH)3.
B. Cr(OH)3.
C. Ba(OH)2.
D. Pb(OH)2.
Câu 16. Muối axit là
A. Muối tạo bởi bazơ yếu và axit mạnh.
B. Muối vẫn còn hiđro có khả năng phân li ra cation H+.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối có khả năng phản ứng với bazơ.
Phần II: Tự luận
Câu 1(1.5 điểm) Viết phương trình điện li của:
a) Na2SO4.
b) HCl.
c) HCOOH.
Câu 2 (1.5 điểm). Hoàn thành các phương trình hóa học sau:
a. Viết phương trình hóa học dạng ion rút gọn của phản ứng sau
Na2CO3 + HCl → ? + ? + ?
b. Viết một phương trình hóa học dạng phân tử của phương trình ion rút gọn sau
Cu2+ + 2OH- → Cu(OH)2↓
Câu 3 (3.0 điểm). Trộn 150 ml dung dịch H2SO4 0,1M với 100 ml dung dịch BaCl2 0,1M thu được kết tủa trắng.
1. Viết phương trình phân tử và ion rút gọn.
2. Tính khối lượng kết tủa thu được.
3. Xác định các ion có trong dung dịch sau phản ứng (kèm số mol).
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. B
NaOH + HCl → NaCl + H2O
KOH + NaCl → không xảy ra phản ứng.
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O.
Câu 2. B
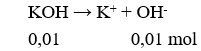
pOH = -log[OH-] = 2 → pH = 14 – pOH = 12.
Câu 3. B
Do hai dung dịch HNO3 và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
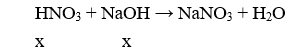
Vậy dung dịch sau phản ứng có pH = 7.
Câu 4. A
CH3COOH ⇌ CH3COO- + H+
Do CH3COOH là chất điện li yếu nên [H+] < 0,10M.
Câu 5. A
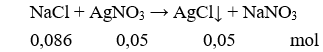
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Câu 6. D
Chất điện li mạnh gồm axit mạnh, bazơ mạnh và hầu hết các muối.
Câu 7. B
Câu 8. B
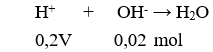
Có 0,2V = 0,02 → V = 0,1 lít = 100 ml.
Câu 9. A
HClO ⇌ H+ + ClO-.
Câu 10. D
Câu 11. C
Câu 12. D
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. D
[H+] = 10-pH = 10-3 = 0,001 (M).
Câu 14. D
NaCl rắn, khan không dẫn được điện.
Câu 15. C
Ba(OH)2 là bazơ mạnh.
Câu 16. B
Phần II: Tự luận
Câu 1.
a. Na2SO4 → 2Na+ + SO42-
b. HCl → H+ + Cl-
c. HCOOH ⇌ HCOO- + H+.
Câu 2.
a. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
PT ion rút gọn: CO32- + 2H+ → CO2 + H2O
b. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Câu 3.
1. H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
PT ion rút gọn: Ba2+ + SO42- → BaSO4 ↓
2.
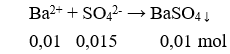
m↓ = 0,01.233 = 2,33 gam.
3. Dung dịch sau phản ứng gồm: SO42-: 0,005 mol; H+: 0,03 mol và Cl-: 0,02 mol.
Xem thêm bộ đề thi Hóa học 11 mới năm 2026 chọn lọc khác:
- Đề thi Hóa học 11 Học kì 1 có đáp án (9 đề)
- Đề kiểm tra Hóa học 11 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 11 Giữa kì 2 có đáp án (5 đề)
- Đề thi Hóa học 11 Học kì 2 có đáp án (5 đề)
Để học tốt lớp 11 các môn học sách mới:
- Giải bài tập Lớp 11 Kết nối tri thức
- Giải bài tập Lớp 11 Chân trời sáng tạo
- Giải bài tập Lớp 11 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 11 (các môn học)
- Giáo án điện tử lớp 11 (các môn học)
- Giáo án Toán 11
- Giáo án Ngữ văn 11
- Giáo án Tiếng Anh 11
- Giáo án Vật Lí 11
- Giáo án Hóa học 11
- Giáo án Sinh học 11
- Giáo án Lịch Sử 11
- Giáo án Địa Lí 11
- Giáo án KTPL 11
- Giáo án HĐTN 11
- Giáo án Tin học 11
- Giáo án Công nghệ 11
- Giáo án GDQP 11
- Đề thi lớp 11 (các môn học)
- Đề thi Ngữ Văn 11 (có đáp án)
- Chuyên đề Tiếng Việt lớp 11
- Đề cương ôn tập Văn 11
- Đề thi Toán 11 (có đáp án)
- Đề thi Toán 11 cấu trúc mới
- Đề cương ôn tập Toán 11
- Đề thi Tiếng Anh 11 (có đáp án)
- Đề thi Tiếng Anh 11 mới (có đáp án)
- Đề thi Vật Lí 11 (có đáp án)
- Đề thi Hóa học 11 (có đáp án)
- Đề thi Sinh học 11 (có đáp án)
- Đề thi Lịch Sử 11
- Đề thi Địa Lí 11 (có đáp án)
- Đề thi KTPL 11
- Đề thi Tin học 11 (có đáp án)
- Đề thi Công nghệ 11
- Đề thi GDQP 11 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

