Top 10 Đề kiểm tra Hóa học 9 Chương 1 có đáp án, cực hay
Top 10 Đề kiểm tra Hóa học 9 Chương 1 có đáp án, cực hay
Để học tốt Hóa học lớp 9, dưới đây là danh sách Top 10 Đề kiểm tra Hóa học 9 Chương 1 có đáp án, cực hay gồm các đề kiểm tra 15 phút, 45 phút (1 tiết). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi Hóa học 9.
Đề kiểm tra 15 phút
Đề kiểm tra 1 tiết
Đề kiểm tra 15 phút Hóa học 9 Chương 1
Phần trắc nghiệm
Câu 1: (1 điểm) Trong các oxit sau oxit nào là oxit bazo?
A. SO2 B. CuO C. Al2O3 D. CO
Câu 2: (1 điểm) Để phân biệt các oxit: Na2O, P2O5, CaO người ta có thể dùng
A. nước và quỳ tím
B. dung dịch HCl
C. nước
D. quỳ tím khô
Câu 3: (1 điểm) Để thu khí O2 từ hỗn hợp gồm: O2, CO2, SO2 người ta cho hỗn hợp khí đi qua
A. dung dịch NaOH lấy dư
B. nước
C. CaO (rắn)
D. dung dịch axit sunfuric
Câu 4: (1 điểm) Canxi oxit tác dụng được với: nước (1), dung dịch axit HCl (2), khí CO2 (3), khí CO (4). Các tính chất đúng là thêm:
A. (1), (4)
B. (1), (2), (4)
C. (2), (3), (4)
D. (1), (2), (3)
Câu 5: (1 điểm) Cho Mg và các dung dịch: H2SO4, HCl, NaOH. Số sản phẩm tạo ra (không kể H2O) khi cho các chất đó tác dụng với nhau từng đôi một là:
A. 3 B. 4 C. 5 D. 6
Câu 6: (2 điểm) Cho sơ đồ sau: C → X1 → X2 → X3 → Ca(OH)2.
Trong đó X, X2, X3 lần lượt là:
A. CO2, CaCO3, CaO.
B. CO, CO2, CaCl2.
C. CO2, Ca(HCO3)2, CaO.
D. CO, CaO, CaCl2.
Câu 7: (1 điểm) Để phân biệt canxi oxit và natri oxit có thể dùng:
A. nước
B. dung dịch axit clohidric
C. khí cacbon đioxit
D. phản ứng phân hủy
Câu 8: (2 điểm) Nung 120 gam một loại đá vôi (trong đó CaCO3 chiếm 80% khối lượng) với hiệu suất 90%, khối lượng CaO thu được là (Ca = 40, C = 12, O = 16).
A. 96 gam B. 48,38 gam C. 86,4 gam D. 67,2 gam
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | A | A | D | C | A | A | B |
Câu 1:B
Oxit của kim loại là oxit bazo, Al2O3 là oxit lưỡng tính.
Câu 2:A
Hòa tan vào nước Na2O tạo ra dung dịch kiềm; P2O5 tạo ra dung dịch axit; CaO tạo ra bazo ít tan, dung dịch không trong suốt như dung dịch NaOH.
Câu 3:A
CO2 và SO2 là 2 oxit axit nên bị dung dịch NaOH tác dụng tạo muối tan trong nước. O2 không tác dụng dung dịch NaOH và không tan trong nước.
Câu 4:D
CaO + H2O → Ca(OH)2
CaO + 2HCl → CaCl2 + H2O
CaO + CO2→ CaCO3
Câu 5:C
H2SO4 + 2NaOH → Na2SO4 + H2O
H2SO4 + Mg → MgSO4 + H2
HCl + NaOH → NaCl + H2O
2HCl + Mg → MgCl2 + H2
Câu 6:A
C + O2 to→ CO2
CaO + CO2→ CaCO3
CaCO3 to→ CaO + CO2
CaO + H2O → Ca(OH)2
Câu 7:A
Ca(OH)2 tạo ra bazo ít tan dung dịch không trong suốt như dung dịch NaOH.
Câu 8:B
CaCO3 to→ CaO + CO2
mCaCO3 = 120 x 0,8 = 96 (g).
Theo PTHH => mCaO = (96 x 56)/100 = 53,76 (g)
=> mCaO thực tế = 53,76 x 0,9 = 43,38 (g).
Đề kiểm tra 1 tiết Hóa học 9 Chương 1
Phần trắc nghiệm (4 điểm)
Câu 1: Có các chất sau: Na2O, Fe2O3, CaO, SO2, CO2, H2O. Những chất có thể điều chế bằng phản ứng hóa hợp là
A. CaO, Fe2O3, SO2, CO2, H2O
B. Fe2O3, CaO, SO2, CO2, H2O, Na2O
C. Na2O, Fe2O3, CO2, SO2, H2O
D. Na2O, CaO, CO2, H2O, Fe2O3
Câu 2: Khí CO có lẫn khí SO2 và khí CO2. Có thể loại SO2, CO2 bằng cách cho hỗn hợp qua
A. lượng dư dung dịch Ca(OH)2
B. dung dịch NaOH
C. H2O
D. CuO nung mạnh
Câu 3: Trong phòng thí nghiệm K2O rất khó bảo quản, vì K2O
A. rất dễ tác dụng với hơi nước và khí CO2 trong không khí
B. kém bền dễ bị ánh sang phân hủy
C. rất dễ tác dụng với khí O2 trong không khí
D. kém bền dễ bị phân hủy bởi nhiệt
Câu 4: Kim loại X tác dụng với dung dịch H2SO4 cho khí H2. Khí H2 tác dụng oxit kim loại Y cho kim loại Y khi nung nóng. Cặp kim loại X – Y có thể là
A. Zn – Cu
B. Cu - Ag
C. Ag - Pb
D. Cu - Pb
Câu 5: Có thể phân biệt 2 chất rắn CaO, P2O5 bằng cách hòa tan từng chất vào nước, rồi thử dung dịch tạo ra với
A. dung dịch HCl
B. dung dịch NaOH
C. kim loại Cu
D. quỳ tím
Câu 6: Để tác dụng hết một lượng CaO người ta phải dung một lượng nước bằng 60% khối lượng CaO đó. Tỉ lệ lượng nước đã dung so với lượng nước theo phương trình hóa học là
A. 2,24 B. 2,63 C. 1,87 D. 3,12
Câu 7: Cho dãy các oxit: MgO, Fe2O3, K2O, SO2, CO2, NO. Số phản ứng xảy ra sau khi cho mỗi oxit lần lượt tác dụng với dung dịch HCl và dung dịch NaOH là
A. 8 B. 5 C. 6 D. 7
Câu 8: Chất cần dung để điều chế Fe từ Fe2O3 là
A. H2 B. CO2 C. H2SO4 D. Al2O3
Phần tự luận (6 điểm)
Câu 9: (2 điểm) Chỉ dung một trong các chất: CuO, Cu, CO, SO3, H2O, SO2, FeO để điền vào các chỗ trống trong sơ đồ sau:
1. _____ + H2O → H2SO4 2. H2O + _____ → H2SO3
3. _____ + HCl → CuCl2 + H2O 4. FeO + _____ → Fe + CO2
Câu 10: (2 điểm) Viết các phương trình hóa học theo chuyển hóa sau (ghi rõ điều kiện nếu có): FeS2 → SO2 → SO3 → H2SO4 → BaSO4
Câu 11: (2 điểm) Lấy 10 g CaCO3 và CaSO4 tác dụng với dung dịch HCl dư tạo thành 0,56 lít khí (đktc). Tính thành phần % theo khối lượng mỗi muối trong hỗn hợp ban đầu. (Ca=40, C=12, O=16, S=32)
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | A | A | A | D | C | B | A |
Câu 1:B
Fe2O3, CaO, SO2, CO2, H2O, Na2O
Các ví dụ:
4Fe + 3O2 to→ 2Fe2O3
2Ca + O2 to→ 2CaO
S + O2 to→ SO2
C + O2 to→ CO2
2H2 + O2 to→ 2H2O
4Na + O2 to→ 2Na2O
Câu 2:A
CO2 và SO2 là 2 oxit axit nên bị dung dịch Ca(OH)2 tác dụng tạo muối. CO không tác dụng với dung dịch Ca(OH)2 và không tan trong nước, thoát ra khỏi dung dịch.
Câu 3:A
Do các phản ứng:
K2O + H2O → 2KOH
K2O + CO2 → K2CO3
2KOH + CO2 → K2CO3 + H2O
KOH + CO2 → KHCO3
Câu 4:A
Các phản ứng:
Zn + H2SO4 → ZnSO4 + H2
H2 + CuO to→ Cu + H2O
Câu 5:D
CaO + H2O → Ca(OH)2. Dung dịch Ca(OH)2 làm quỳ tím hóa xanh.
P2O5 + 3H2O → 2H3PO4. Dung dịch H3PO4 làm quỳ tím hóa đỏ.
Câu 6:C
CaO + H2O → Ca(OH)2.
Cứ 56 gam CaO theo phương trình cần 18 gam nước.
Cũng cứ 56 gam CaO lượng nước đem dùng = 56 x 0,6 = 33,6 gam
Lượng nước đã dùng so với lượng nước theo phương trình hóa học = 33,6/18 = 1,87 g.
Câu 7:B
Phương trình hóa học:
MgO + 2HCl → MgCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
K2O + 2HCl → 2KCl + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Câu 8:A
3H2 + Fe2O3 to→ 2Fe + 3H2O
Câu 9:
1. SO3 + H2O → H2SO4
2. H2O + SO2 → H2SO3
3. CuO + 2HCl → CuCl2 + H2O
4. FeO + CO to→ Fe + CO2
Viết đúng mỗi phương trình 0,5 điểm.
Câu 10:
Viết các phương trình hóa học theo chuyển hóa sau (ghi rõ điều kiện nếu có):
4FeS2 + 11O2 to→ 8SO2 + 2Fe2O3
2SO2 + O2 to→ 2SO3
SO3 + H2O → H2SO4
H2SO4 + BaCl2 → BaSO4 + 2HCl
Viết đúng mỗi phương trình 0,5 điểm.
Câu 11:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
CaSO4 không tác dụng với dung dịch HCl.
nCO2 = 0,56/22,4= 0,025 mol
=> nCaCO3 = 0,025 mol
=> mCaCO3 = 0,025 x 100 = 2,5 gam.
Thành phần % theo khối lượng của CaCO3 = 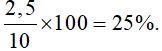
Thành phần % theo khối lượng của CaSO4 = 100% - 25% = 75%
Xem thêm các đề kiểm tra, đề thi Hóa Học lớp 9 chọn lọc, có đáp án hay khác:
Loạt bài Đề thi Hóa lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



