Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 4)
Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 4)
Phần trắc nghiệm (4 điểm: mỗi câu 0,5 điểm)
Câu 1: Có thể phân biệt được 2 khí C2H4 và SO2 mà chỉ dùng dung dịch
A. Ca(OH)2 B. NaOH C. NaCl D. Na2CO3
Câu 2: Cho phản ứng 2CH4 150oC→ C2H2 + 3H2
Để biết phản ứng đã xảy ra người ta
A. cho hỗn hợp sau phản ứng sục vào dung dịch brom dung dịch brom mất màu
B. đốt hỗn hợ sau phản ứng, sẽ có phản ứng cháy và tỏa nhiều nhiệt
C. quan sát thấy có hiện tượng sủi bọt do có khí H2 thoát ra
D. so sánh thể tích hỗn hợp khí trước và sau khi đốt sẽ tự có giảm thể tích.
Câu 3: Số công thức cấu tạo có thể có của phân tử C3H8O là
A. 1 B. 3 C. 4 D. 2
Câu 4: Một dãy các hợp chất có công thức cấu tạo viết gọn:
CH≡CH, CH≡C – CH3, CH≡C – CH2 – CH3,…
Một hidrocacbon mạch hở, phân tử có cấu tạo tương tự và có n nguyên tử cacbon sẽ có công thức phân tử là
A. CnH2n+2 B. CnH2n C. CnH2n-2 D. CnH2n-6
Câu 5: Hợp chất hữu cơ X chứa các nguyên tố C, H, O trong đó thành phần % khối lượng của C là 52,17% và hidro là 13,04%. Biết khối lượng mol của X là 46 g.
Công thức phân tử của X là (H=1, C=12, O=16)
A. C2H6O B. CH4O C. C3H8O D. C2H6O2
Câu 6: Khí C2H2 có lẫn khí CO2, SO2 và hơi H2O. Để thu được C2H2 tinh khiết có thể cho hỗn hợp qua
A. dung dịch KOH dư, sau đó qua H2SO4 đặc
B. dung dịch KOH dư
C. H2SO4 đặc
D. H2SO4 đặc, sau đó qua dung dịch KOH dư
Câu 7: Đốt cháy hết hỗn hợp gồm metan và axetilen có thể tích 5,6 lít (đktc), cho sản phẩm quan một lượng dư dung dịch Ca(OH)2 thu được 40 g CaCO3.
Thành phần % theo thể tích của axetilen trong hỗn hợp ban đầu là
A. 60% B. 50% C. 40% D. 30%
Câu 8: Từ CaC2, nước, người ta có thể điều chế trực tiế chất nào trong các chất sau?
A. etan (C2H6)
B. etilen (C2H4)
C. axetilen (C2H2)
D. metan (CH4)
Phần tự luận
Câu 9: (2,5 điểm) Viết các phương trình phản ứng:
a) Chứng tỏ benzene vừa có khả năng tham gia phản ứng thế, vừa có khả năng tham gia phản ứng cộng (ghi rõ điều kiện).
b) Đốt cháy hợp chất CnH2n+2. Nhận xét về tỉ lệ số mol giữa H2O và CO2 tạo ra.
Câu 10: (1,5 điểm) Tính thể tích etilen (đktc) cần dùng để điều chế 1kg polietilen.
Biết hiệu suất phản ứng 80% (cho H=1, C=12).
Câu 11: (2 điểm) Khi cho metan tác dụng với clo có chiếu sang người ta thu được nhiều sản phẩm trong đó có chất X, với thành phần % khối lượng của cacbon là 14,12%. Xác định công thức phân tử của X (cho C=12, H=1, Cl=35,5).
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | A | A | B | C | A | A | A | C |
Câu 1:A
Khí etilen không tác dụng với các dung dịch Ca(OH)2, NaOH, NaCl, Na2CO3.
Khí SO2 tạo kết tủa với dung dịch Ca(OH)2, có phản ứng với dung dịch NaOH nhưng không có hiện tượng gì.
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Câu 2:A
Để biết phản ứng đã xảy ra, người ta kiểm tra sự có mặt sản phẩm phản ứng:
Với: 2CH4 1500oC→ C2H2 + 3H2
Sản phẩm phản ứng là C2H2, H2. Chỉ có C2H2 làm mất màu dung dịch Brom.
Câu 3:B
Số công thức cấu tạo có thể có của phân tử C3H8O:
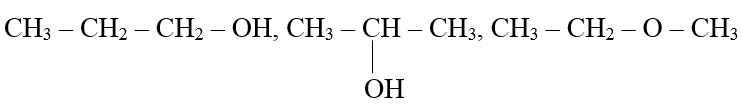
Câu 4:C
Dãy các chất CH≡CH, CH≡C – CH3, CH≡C – CH2 – CH3,… là những hợp chất mạch hở, phân tử có một liên kết ba và đều thỏa mã công thức chung CnH2n-2 (n nguyên dương ≥ 2).
Câu 5:A
Thành phần % khối lượng của O = 100 – (52,17 + 13,04) = 34,79%
nC : nH : nO = 52,17/12 : 13,04 : 34,79/16 = 4,35 : 13,04 : 2,17 = 2: 6: 1
=> Công thức đơn giản nhất là C2H6O.
M = (2x12+6+16)n = 46 => n =1
Vậy công thức phân tử: C2H6O
Câu 6:A
Dung dịch KOH dư hấp thụ hết khí CO2, SO2, H2SO4 đặc giữ hết hơi H2O. Dùng dung dịch KOH sau sẽ không giữ hết hơi H2O.
Câu 7:A
CH4 + 2O2 → CO2 + 2H2O
2C2H2 + 5O2 → 4CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Gọi x, y lần lượt là số mol của CH4, C2H4
x + y = 5,6/22,4 = 0,25
Số mol CO2 = x + 2y = 0,4 => x = 0,1 mol; y = 0,15 mol
Thành phần % theo thể tích của axetilen:
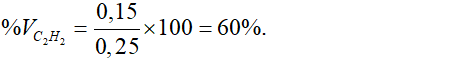
Câu 8:C
CaC2 + 2H2O → C2H2 + Ca(OH)2
Câu 9:
a) Phản ứng thế của benzen: C6H6 + Br2 to→ C6H5Br+ HBr
Phản ứng cộng của benzen: C6H6 + 3H2 to→ C6H12
b) Đốt cháy hợp chất CnH2n+2:
CnH2n+2 + (3n+1)/2 O2 to→ nCO2 + (n+1)H2O (n ≥ 1)
Số mol H2O luôn luôn lớn hơn số mol CO2
Câu 10:
nCH2=CH2 to,xt→ (CH2 – CH2)n
Khối lượng etilen phải dùng = (1000 x 100)/80 = 1250 gam.
Số mol etilen = 1250/28 = 44,64 mol
Thể tích etilen (đktc) = 1250x22,4/28 = 1000 (lít).
Câu 11:
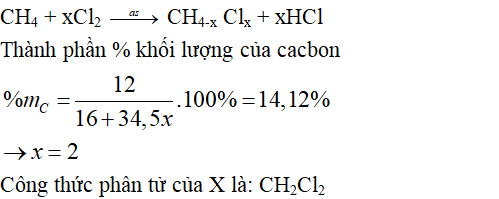
Các đề kiểm tra Hóa 9 có đáp án khác:
Loạt bài Đề thi Hóa lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



