Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 1)
Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 1)
Phần trắc nghiệm (4 điểm: mỗi câu 0,5 điểm)
Câu 1: Phân tử chất hữu cơ X có 2 nguyên tố C, H. Tỉ khối hơi của X so với hidro là 22. Công thức phân tử của X là
A. C4H8 B. C3H8 C. C3H6 D. C6H6
Câu 2: Cho công thức cấu tạo của các chất (I), (II), (III)
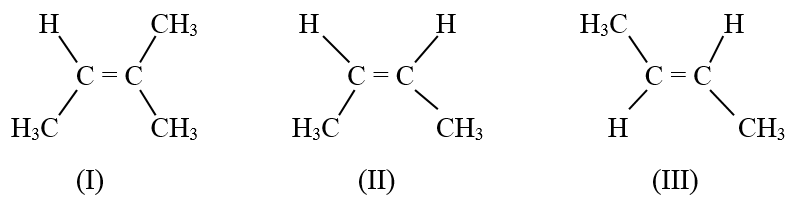
Các chất có cùng công thức phân tử là
A. (II), (III)
B. (I), (III)
C. (I), (II)
D. (I), (II), (III)
Câu 3: Đốt cháy hoàn toàn m gam một hỗn hợp chất hữu cơ X (có chứa 2 nguyên tố C, H) thu được 3,36 lít CO2 (đktc) và 4,5 gam H2O. Giá trị của m là (cho H=1, C=12, O=16)
A. 4,6 g B. 2,3 g C. 11,1 g D. không thể xác định
Câu 4: Để biết phản ứng: CH4 + Cl2 a/s→ CH3Cl + HCl đã xảy ra chưa, người ta
A. kiểm tra sản phẩm phản ứng bằng quỳ tím ẩm, quỳ tím hóa đỏ tức phản ứng đã xảy ra.
B. chỉ cần cho thể tích CH4 bằng thể tích Cl2
C. kiểm tra thể tích hỗn hợp khí, nếu có phản ứng xảy ra thì thể tích hỗn hợp khí tăng.
D. có thể kiểm tra clo, nếu clo còn tức phản ứng chưa xảy ra.
Câu 5: Phản ứng nCH2=CH2 xt→ (CH2-CH2)n được gọi là phản ứng
A. trùng hợp B. cộng C. hóa hợp D. trùng ngưng
Câu 6: Đốt cháy 2,6 g một chất hữu cơ X, người ta thu được 8,8 g CO2 và 1,8 g H2O. Tỉ khối hơi chất X đối với H2 là 13. Công thức phân tử chất X là (H=1, C=12, O=16)
A. C2H4 B. C2H2 C. CH4 D. C6H6
Câu 7: Thể tích không khí (O2 chiếm 20% theo thể tích, đktc) cần để đốt cháy 2,6 g C2H2 là (cho H=1, C=12)
A. 3,36 lít B. 4,48 lít C. 13,44 lít D. 28 lít
Câu 8: Trong những hidrocacbon sau, những chất nào có phản ứng thế với brom?
CH3-CH3, CH3-CH=CH2, CH3-C≡CH, C6H6
A. CH3-CH3, CH3-CH=CH2.
B. CH3-C≡CH, C6H6
C. CH3-CH3, C6H6
D. CH3-CH=CH2, CH3-C≡CH
Phần tự luận
Câu 9: (2,5 điểm) Etilen và axetilen có tính chất hóa học giống nhau và khác nhau ở những điểm nào?
Câu 10: (2,5 điểm) Tính thể tích khí C2H2 (đktc) tạo ra khi cho 10 gam CaC2 (có 36% tạp chất) tác dụng hết với H2O (cho C=12, Ca=14).
Câu 11: (1 điểm) Một hỗn hợp gồm C2H2 và C2H4 có thể tích 5,6 lít khí (đktc) cho qua dung dịch Br2 dư, dung dịch này nặng thêm 6,8 g.
Tính thể tích mỗi khí trong hỗn hợp ban đầu (cho H=1, C=12).
Đáp án và hướng dẫn giải
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | B | A | B | A | A | B | D | C |
Câu 1:B
dX/H2 = 22 => M = 2 x 22 = 44.
Gọi công thức phân tử chất hữu cơ X là: CxHy => 12x + y = 44
x, y nguyên, dương. Nghiệm thích hợp là C3H8.
Câu 2:A
(II), (III) đều có công thức phân tử C4H8.
Câu 3:B
m = mC + mH = (3,36 x 12)/(22,4)+(4,5 x 2)/18 = 2,3 gam.
Câu 4:A
Khi tác dụng với nước (ẩm), khí HCl tạo ra dung dịch axit nên làm quỳ tím hóa đỏ.
Khí clo khi ẩm có tính tẩy màu, nên bằng cách nào đó người ta loại khí clo còn, chỉ kiểm tra sản phẩm phản ứng (khí HCl).
Câu 5:A
Câu 6:B
dX/H2 = 13 => M = 2 x 13 = 26
mC = (8,8 x 12)/44 = 2,4 gam; mH = (1,8 x 2)/( 18) = 0,2 gam
=> mO = 2,6 – (2,4 + 0,2) = 0
nC : nH = 2,4/12:0,2/1 = 1 : 1. Công thức đơn giản nhất: CH
Công thức phân tử (CH)n => M = (12+1)n = 26 => n=2
X là C2H2
Câu 7:D
2C2H2 + 5O2→ 4CO2 + 2H2O
nC2H2 = 2,6: 26 = 0,1 mol => nO2 = 0,25 mol
Thể tích không khí: 0,25 x 22,4 x 100/20 = 28 lít (đktc)
Câu 8:C
CH3 – CH3 tương tự CH4 có phản ứng thế với brom khi có ánh sáng và brom ở thể khí tương tự với khí clo.
Benzen (C6H6) khi có Fe làm xúc tác brom sẽ thế nguyên tử H của benzen tương tự như clo.
Câu 9:
Etilen và axetilen có tính chất hóa học gần giống nhau:
- Cùng có phản ứng cộng với dung dịch brom:

Câu 10:
CaC2 + 2H2O → Ca(OH)2 + C2H2
mCaC2 = (10 x (100-36))/(100 ) = 6,4 gam.
=> nCaC2 = 6,4 : 64 = 0,1 mol => nC2H2 = 0,1 mol
Thể tích khí C2H2 (đktc) tạo ra = 0,1 x 22,4 = 2,24 lít
Câu 11:
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H2Br2
Gọi x, y lần lượt là số mol của C2H2 và C2H4 trong 5,6 lít hỗn hợp.
Ta có: x + y = 5,6/22,4 = 0,25
Dung dịch Br2 nặng thêm = khối lượng C2H2 + khối lượng C2H4 = 26x + 28y = 6,8
Giải ra ta có: x = 0,1 mol, y = 0,15 mol
Vậy: Thể tích C2H2 (đktc) = 0,1 x 22,4 = 2,24 lít
Thể tích C2H4 (đktc) = 0,15 x 22,4 = 3,36 lít
Các đề kiểm tra Hóa 9 có đáp án khác:
Loạt bài Đề thi Hóa lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



