NaOH + Cl2 → NaCl + NaClO3 + H2O | NaOH ra NaCl | NaOH ra NaClO3 | Cl2 ra NaCl | Cl2 ra NaClO3
Phản ứng NaOH + Cl2 -90oC hay NaOH ra NaCl hoặc NaOH ra NaClO3 hoặc Cl2 ra NaCl hoặc Cl2 ra NaClO3 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về NaOH có lời giải, mời các bạn đón xem:
6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O
1. Phương trình hoá học của phản ứng Cl2 tác dụng với NaOH
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
Cách lập phương trình hoá học:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử và chất oxi hoá đều là: Cl2.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
2. Điều kiện để Cl2 tác dụng với NaOH sinh NaClO3
Phản ứng diễn ra ngay ở khoảng 900C.
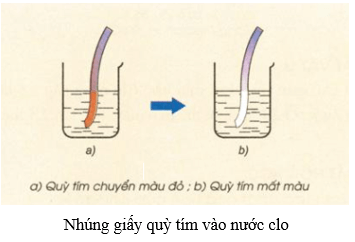
3. Cách tiến hành thí nghiệm
Dẫn khí clo vào ống nghiệm đã để sẵn dung dịch NaOH đun nóng và mẩu giấy quỳ tím.
4. Hiện tượng phản ứng
Ban đầu mẩu quỳ có màu xanh, sau khi phản ứng xảy ra màu quỳ bị mất.
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
5.1. Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
5.2. Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 : 1.
- Phương trình hóa học:
H2 + Cl2 2HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
5.3. Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp hydrochloric acid và axit hipoclozơ.
- Phương trình hóa học:
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O →H2SO4 + 2HCl
6. Bài tập vận dụng liên quan
Câu 1: Trong phản ứng: Cl2 + H2O HCl + HClO clo đóng vai trò
A. Là chất khử
B. Vừa là chất oxi hóa, vừa là chất khử
C. Là chất oxi hóa
D. Không là chất oxi hóa, không là chất khử
Hướng dẫn giải:
Đáp án B
Xét sự thay đổi số oxi hóa của Cl:
+ Tăng từ 0 lên +1 (trong HClO)
+ Giảm từ 0 xuống -1 (trong HCl)
⇒ Clo vừa là chất khử vừa là chất oxi hóa
Câu 2: Nước clo có màu:
A. vàng lục
B. vàng da cam
C. vàng đậm
D. vàng nhạt
Hướng dẫn giải:
Đáp án A
Dung dịch nước clo là dung dịch hỗn hợp giữa Cl2, HCl và HClO nên có màu vàng lục, mùi hắc của clo.
Câu 3: Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
A. Có khói trắng
B. Có khói nâu
C. Có khói đen
D. Có khói tím
Hướng dẫn giải:
Đáp án B
2Fe + 3Cl2 → 2FeCl3 (có màu nâu)
Câu 4. Cho sơ đồ chuyển hóa sau: Cl2 → X → Y → Z → X → Cl2. Trong đó X, Y, Z là các chất rắn; Y và Z đều chứa natri. X, Y, Z là
A. NaCl, NaBr, Na2CO3
B. NaBr, NaOH, Na2CO3
C. NaCl, Na2CO3, NaOH
D. NaCl, NaOH, Na2CO3
Hướng dẫn giải:
Đáp án D
Cl2 → NaCl → NaOH → Na2CO3 → NaCl → Cl2.
2Na + Cl2 → 2NaCl
2NaCl +2H2O 2NaOH + H2 + Cl2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
2NaCl +2H2O 2NaOH + H2 + Cl2
Câu 5. Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình kín chứa khí clo dư, sau phản ứng thì lượng clo trong bình giảm tương ứng 0,4 mol. Khối lượng muối clorua khan thu được là.
A. 65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Hướng dẫn giải
Đáp án D
mmuối = mKL
Câu 6. Nước Gia-ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O. B.NaCl, NaClO, H2O.
C. NaCl, NaClO3, H2O. D. NaCl, NaClO4, H2O.
Hướng dẫn giải
Đáp án B
Cho khí clo tác dụng với dung dịch NaOH loãng ở nhiệt độ thường ta thu được nước Gia-Ven theo PTHH sau: 2NaOH + Cl2 → NaCl + NaClO + H2O.
Câu 7. Clorua vôi có công thức là
A. CaOCl. B. CaOCl2. C. Ca(OCl)2. D. CaCl2.
Hướng dẫn giải
Đáp án B
Vì công thức phân tử của clorua vôi là CaOCl2
Câu 8. Xét phản ứng: 2Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Trong phản ứng trên, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. môi trường.
Hướng dẫn giải
Đáp án B
Câu 9. Brom có lẫn một ít tạp chất là clo. Một trong các hoá chất có thể loại bỏ clo ra khỏi hỗn hợp là
A. KBr. B. KCl. C. H2O. D. NaOH.
Hướng dẫn giải
Đáp án A
- KBr được vì chỉ có clo phản ứng theo phản ứng sau:
Cl2 + 2KBr → 2KCl + Br2.
- KCl không được ⇒ Ko tách được clo.
- H2O xảy ra phản ứng của clo và brom với nước và một phần tan trong nước ⇒ ko tách được.
- NaOH cả brom và clo đều phản ứng ⇒ không tách được.
Câu 10. Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ dưới đây:
Khí X là
A. Cl2. B. N2. C. H2. D. NH3.
Hướng dẫn giải
Đáp án A
Phương pháp ngửa bình thu khí nặng hơn không khí => Cl2 ( M = 71 > 29) .
Xem thêm các phương trình hóa học hay khác:
- 2NaOH + CO2 → Na2CO3 + H2O
- NaOH + CO2 → NaHCO3
- 2NaOH + SO2 → Na2SO3 + H2O
- NaOH + SO2 → NaHSO3
- NaOH + HCl → NaCl + H2O
- NaOH + HNO3 → NaNO3 + H2O
- 2NaOH + H2SO4 → Na2SO4+ 2H2O
- 2NaOH + CuSO4 → Na2SO4+ Cu(OH)2 ↓
- 2NaOH + FeSO4 → Na2SO4 + Fe(OH)2 ↓
- 3NaOH + FeCl3 → 3NaCl+ Fe(OH)3 ↓
- 2NaOH + Mg(NO3)2 → 2NaNO3 + Mg(OH)2 ↓
- NaOH + Al(OH)3 → NaAlO2+ 2H2O
- NaOH + Cr(OH)3 → NaCrO2+ 2H2O
- 2NaOH + Zn(OH)2 ↓ → Na2ZnO2 (dd)+ 2H2O
- NaOH + NaHCO3 → Na2CO3 + H2O
- NaOH + NaHSO3 → Na2SO3 + H2O
- 2NaOH + Ba(HSO3)2 → Na2SO3 + BaSO3 ↓ + 2H2O
- 2NaOH + Ba(HCO3)2 → Na2CO3 + BaCO3 ↓ + 2H2O
- 2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3 ↓ + 2H2O
- 2NaOH + Ca(HSO3)2 → Na2SO3 + CaSO3 ↓ + 2H2O
- 2NaOH + Cl2 → NaCl + NaClO + H2O
- 2NaOH + Al2O3 → 2NaAlO2 + H2O
- 2NaOH + ZnO → Na2ZnO2 + H2O
- 2NaOH + H2S → Na2S + 2H2O
- NaOH + H2S → NaHS + H2O
- NaOH + CH3COOH → CH3COONa + H2O
- NaOH + NH4Cl -to→ NaCl+ NH3 ↑ + H2O
- NaOH + NH4NO3 -to→ NaNO3+ NH3 ↑ + H2O
- 2NaOH + (NH4)2SO4 -to→ Na2SO4+ 2NH3 ↑ + 2H2O
- CH3COOCH3 + NaOH -H2O,to→ CH3COONa + CH3OH
- CH3COOC2H5 + NaOH -H2O,to→ CH3COONa + C2H5OH
- C2H5Cl + NaOH -to→ NaCl + C2H5OH
- C2H5Br + NaOH -to→ NaBr + C2H5OH
- C2H5Br + NaOH -toC2H5OH→ NaBr + C2H4 ↑ + H2O
- C2H5Cl + NaOH -toC2H5OH→ NaCl + C2H4 ↑ + H2O
- C6H5OH + NaOH → C6H5ONa + H2O
- 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
- Zn + 2NaOH -to→ Na2ZnO2 + H2 ↑
- NaOH + NaHS → Na2S + H2O
- 2NaOH + 2KHS → K2S + Na2S + 2H2O
- 2NaOH + 2KHSO3 → K2SO3 + Na2SO3 + 2H2O
- 2NaOH + 2KHCO3 → K2CO3 + Na2CO3 + 2H2O
- CH3COONa + NaOH -CaO,to→ CH4 ↑ + Na2CO3
- H2N-CH2-COOH + NaOH → H2N-CH2-COONa + H2O
- AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
- ZnCl2 + 2NaOH → Zn(OH)2 ↓ + 2NaCl
- Si + 2NaOH + H2O → Na2SiO3 + 2H2 ↑
- SiO2 + 2NaOH -to→ Na2SiO3 + H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



