Giáo án Hóa 12 Cánh diều Bài 17: Nguyên tố nhóm IA
Giáo án Hóa 12 Cánh diều Bài 17: Nguyên tố nhóm IA
Chỉ từ 200k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Cánh diều (cả năm) bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: Gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. Mục tiêu:
1. Kiến thức:
- Nêu được trạng thái tự nhiên của nguyên tố nhóm IA.
- Nêu được xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của kim loại nhóm IA.
- Giải thích được nguyên nhân khối lượng riêng nhỏ và độ cứng thấp của kim loại nhóm IA.
- Giải thích được nguyên nhân kim loại nhóm IA có tính khử mạnh hơn so với các nhóm kim loại khác. Thông qua mô tả thí nghiệm (hoặc quan sát qua video), nêu được mức độ phản ứng tăng dần từ lithium, sodium, potassium khi chúng phản ứng với nước, chlorine và oxygen.
- Giải thích được trạng thái tồn tại của nguyên tố nhóm IA trong tự nhiên. Trình bày được cách bảo quản kim loại nhóm IA.
- Tìm hiểu và trình bày được ứng dụng của sodium chloride; trình bày được quá trình điện phân dung dịch sodium chloride và các sản phẩm cơ bản của công nghiệp chlorine – kiềm.
- Giải thích được các ứng dụng phổ biến của sodium hydrogencarbonate, sodium carbonate và phương pháp Solvay sản xuất soda.
- Thực hiện được thí nghiệm (hoặc quan sát video thí nghiệm) phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa.
2. Năng lực:
* Năng lực chung:
- Tự chủ và tự học: Chủ động, tích cực tìm hiểu về tính chất vật lí, tính chất hoá học, trạng thái tồn tại của nguyên tố hay các hợp chất nhóm IA trong tự nhiên.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về xu hướng biến đổi tính chất vật lí, tính chất hoá học hay các ứng dụng phổ biến của các hợp chất nhóm IA; Hoạt động nhóm và cặp đôi một cách hiệu quả, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
- Giải quyết vấn đề và sáng tạo: Liên hệ thực tiễn nhằm giải quyết các vấn đề trong thực tiễn.
* Năng lực hoá học
- Nhận thức hoá học: Nêu được trạng thái tự nhiên của nguyên tố nhóm IA; Nêu được xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của kim loại nhóm IA; Giải thích được nguyên nhân khối lượng riêng nhỏ và độ cứng thấp của kim loại nhóm IA; Giải thích được nguyên nhân kim loại nhóm IA có tính khử mạnh hơn so với các nhóm kim loại khác; Nêu được khả năng tan trong nước của các hợp chất nhóm IA; Trình bày được quá trình điện phân dung dịch sodium chloride và các sản phẩm cơ bản của công nghiệp chlorine – kiềm.
- Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Thông qua mô tả thí nghiệm (hoặc quan sát qua video), nêu được mức độ phản ứng tăng dần từ lithium, sodium, potassium khi chúng phản ứng với nước, chlorine và oxygen; Thực hiện được thí nghiệm (hoặc qua quan sát video thí nghiệm) phân biệt các ion Li+, Na+, K+ bằng màu ngọn lửa.
- Vận dụng kiến thức, kĩ năng đã học: Giải thích được trạng thái tồn tại của nguyên tố nhóm IA trong tự nhiên; Trình bày được cách bảo quản kim loại nhóm IA; Tìm hiểu và trình bày được ứng dụng của sodium chloride; Giải thích được các ứng dụng phổ biến của sodium hydrogencarbonate, sodium carbonate và phương pháp Solvay sản xuất soda; Vận dụng kiến thức đã học để giải thích một số vấn đề trong thực tiễn cuộc sống như các ứng dụng của NaCl trong các lĩnh vực; Đề xuất cách tốt nhất để bảo quản bột giặt, ...
3. Phẩm chất:
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Cẩn thận, trung thực và thực hiện an toàn trong quá trình làm thực hành.
- Có niềm say mê, hứng thú với việc khám phá và học tập hoá học.
II. Thiết bị dạy học và học liệu:
- Hoá chất: Các muối rắn: LiCl, NaCl, KCl.
- Dụng cụ: đèn khí gas, giá ống nghiệm, đĩa thuỷ tinh, bật lửa.
III. Tiến trình bài học:
A. Hoạt động khởi động:
a. Mục tiêu:
- Huy động được vốn hiểu biết, kĩ năng có sẵn của học sinh (về quy luật biến đổi tính chất trong bảng tuần hoàn, năng lượng hoá học, cân bằng hoá học, thuyết acid - base,...) để chuẩn bị cho học bài mới; học sinh cảm thấy vấn đề sắp học rất gần gũi với mình.
- Kích thích sự tò mò, khơi dậy hứng thú của học sinh về chủ đề sẽ học; tạo không khí lớp học sôi nổi, chờ đợi, thích thú.
- Học sinh trải nghiệm qua tình huống có vấn đề, trong đó chứa đựng những nội dung kiến thức, những kĩ năng để phát triển phẩm chất, năng lực mới.
b. Nội dung:
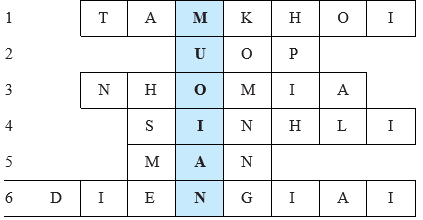
- Giáo viên tổ chức cho học sinh trả lời câu hỏi để tìm các từ hàng ngang, cuối cùng xác định từ khoá.
Câu 1: Cấu trúc tinh thể kim loại kiềm theo kiểu lập phương nào?
Câu 2: “Cá không ăn muối cá ươn” là câu nói về việc bảo quản thực phẩm bằng phương pháp nào?
Câu 3: Nhóm nào gồm những kim loại mạnh nhất trong bảng tuần hoàn?
Câu 4: Tên loại nước muối dùng trong y học dùng để rửa vết thương, súc miệng, nhỏ mắt, nhỏ mũi,...
Câu 5: Từ nào còn thiếu trong câu “Gừng cay muối ... xin đừng quên nhau”?
Câu 6: Loại chất nào trong cơ thể đóng vai trò quan trọng trong trao đổi chất, truyền dẫn xung điện thần kinh?
c. Sản phẩm:
Muối ăn là hợp chất quan trọng nhất và phổ biến nhất của nhóm IA, có nhiều ứng dụng trong đời sống, sản xuất, y học.
d. Tổ chức thực hiện:
- Giáo viên thiết kế các câu hỏi dạng trò chơi Quizizz, Rung chuông vàng,... để khởi động buổi học.
B. Hình thành kiến thức mới
|
Hoạt động 1: Trạng thái tự nhiên Mục tiêu - Dựa vào việc quan sát hình 17.1,hình 17.2 và tìm hiểu thông tin được cung cấp trong SGK, GV hướng dẫn HS nêu được trạng thái tự nhiên của nguyên tố nhóm IA, giải thích được trong các hợp chất, kim loại nhóm IA đều thể hiện số oxi hoá +1. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
HOẠT ĐỘNG CỦA GV – HS |
SẢN PHẨM DỰ KIẾN |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Giao nhiệm vụ học tập: GV yêu cầu HS thảo luận cặp đôi và hoàn thành PHT số 1
Thực hiện nhiệm vụ: HS hoàn thành PHT số 1. Báo cáo, thảo luận: Đại diện nhóm đưa ra nội dung thảo luận. Kết luận, nhận định: GV nhận xét, đưa ra kết luận. |
I. TRẠNG THÁI TỰ NHIÊN
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Hoạt động 2: Tính chất vật lí của đơn chất Mục tiêu - Dựa vào việc tìm hiểu thông tin được trình bày trong SGK, GV hướng dẫn HS nêu được xu hướng biến thiên về nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng và độ cứng từ Li đến Cs, đồng thời giải thích được nguyên nhân khối lượng riêng nhỏ và độ cứng thấp của kim loại nhóm IA. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Giao nhiệm vụ học tập: GV yêu cầu HS thảo luận cặp đôi và hoàn thành PHT số 2
Thực hiện nhiệm vụ: HS hoàn thành PHT số 2. Báo cáo, thảo luận: Đại diện nhóm đưa ra nội dung thảo luận. Kết luận, nhận định: GV nhận xét, đưa ra kết luận. |
II. ĐƠN CHẤT 1. Tính chất vật lí - Nhiệt độ sôi, nhiệt độ nóng chảy của kim loại kiềm có xu hướng giảm từ Li đến Cs. - Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại nhóm khác. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Hoạt động 3: Tính chất hóa học của đơn chất Mục tiêu - Thông qua việc tìm hiểu, thu thập thông tin trong SGK, GV hướng dẫn HS giải thích được nguyên nhân kim loại nhóm IA có tính khử mạnh hơn so với các nhóm kim loại khác, nêu được khả năng tan trong nước của các hợp chất nhóm IA, nêu được mức độ phản ứng tăng dần từ lithium, sodium, potassium khi chúng phản ứng với nước, chlorine và oxygen, giải thích được trạng thái tồn tại của kim loại nhóm IA trong tự nhiên, cách bảo quản kim loại nhóm IA. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Giao nhiệm vụ học tập: GV yêu cầu HS thảo luận cặp đôi và hoàn thành PHT số 3
Thực hiện nhiệm vụ: HS hoàn thành PHT số 3. Báo cáo, thảo luận: Đại diện nhóm đưa ra nội dung thảo luận. Kết luận, nhận định: GV nhận xét, đưa ra kết luận. |
2. Tính chất hóa học a. Xu hướng chung
- Kim loại kiềm có tính khử mạnh: M → M+ + e b. Tác dụng với H2O, O2, Cl2 2Na + 2H2O → 2NaOH + H2 2Na + O2 → Na2O2 2Na + Cl2 → 2NaCl Chú ý: 3 cách để bảo quản kim loại nhóm IA: Ngâm trong dung môi trơ (như dầu hoả); để trong ống chân không hàn kín; để trong bình chứa khí hiếm. |
|||||||||||||||||||||||||||||||||||||||||||||||||
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Cánh diều năm 2026 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các bài soạn Giáo án Hóa học lớp 12 Cánh diều chuẩn khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

