Giáo án Hóa 12 Kết nối tri thức Bài 30: Ôn tập chương 8
Giáo án Hóa 12 Kết nối tri thức Bài 30: Ôn tập chương 8
Chỉ từ 200k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Kết nối tri thức (cả năm) bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: Gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. MỤC TIÊU
1. Kiến thức
- Hệ thống hoá kiến thức về dãy kim loại chuyển tiếp thứ nhất và phức chất.
- Hiểu và VDKT về dãy kim loại chuyển tiếp thứ nhất và phức chất vào thực tiễn sản xuất và cuộc sống.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Sơ đồ Mindmap hệ thống hoá kiến thức về dãy kim loại chuyển tiếp thứ nhất và phức chất.
- Phiếu học tập.
III. TIẾN TRÌNH DẠY HỌC Hoạt động: Luyện tập
Câu hỏi
Câu 1.
a) Từ cấu hình electron của nguyên tử, viết cấu hình electron khi nguyên tử ở trạng thái oxi hoá tương ứng sau:
Ion |
Ti+3 |
Ti+4 |
Cr+2 |
Cr+3 |
Cấu hình electron |
||||
Ion |
Mn2+ |
Mn3+ |
Cu+1 |
Cu+2 |
Cấu hình electron |
b) Chỉ ra các trạng thái oxi hoá mà nguyên tử có cấu hình phân lớp 3d nửa bão hoà và bão hoà.
Câu 2. Khi so sánh với các kim loại K và Ca cùng chu kì, các nguyên tử kim loại chuyển tiếp dãy thứ nhất có bán kính hơn, độ âm điện lớn hơn. Giải thích.
Câu 3. Trình bày phương pháp hoá học phân biệt:
a) Hai dung dịch màu hồng là KOH có chứa phenolphthalein; KMnO4.
b) Ba dung dịch màu xanh là CuSO4; FeSO4; [Cu(NH3)4](OH)2.
c) Ba dung dịch màu vàng là FeCl3; I2 tan trong KI; K2CrO4.
Câu 4. Viết các thông tin còn thiếu vào bảng sau:
Ion trung tâm |
Công thức phối tử |
Tênphối tử |
Công thức ion phức chất |
Số phối trí |
Điện tích của ion phức chất |
Dạng hình học |
Mg2+ |
H2O |
Bát diện |
||||
Ammine |
[Ni(NH3)6]2+ |
|||||
Cu2+ |
Cl− |
Chloro |
Tứ diện |
|||
Fluoro |
[AlF6]3− |
|||||
Ni2+ |
CN− |
Cyano |
Vuông phẳng |
|||
Hydroxo |
[Al(OH)4]− |
Tứ diện |
||||
Oxalato (ox) |
[Fe(ox)3]3− |
Bát diện |
||||
Co2+ |
Ethylene dimamine (en) |
[Co(en)3]3+ |
Câu 5. Số oxi hoá của nguyên tử trung tâm trong phức chất [RhCl(NH3)5](NO3)2 là:
A. +3.
B. 0.
C. +4.
D. +2.
Câu 6. Palladium(II) có xu hướng tạo thành các phức có số phối trí là 4. Một phức chất như vậy được xác định có công thức là PdCl2.3NH3.
a) Đề xuất công thức phù hợp với phức chất và gọi tên.
b) Giả sử dung dịch nước của phức chất trên được cho tác dụng với AgNO3(aq) dư. Có bao nhiêu mol AgCl(s) được tạo thành từ mỗi mol phức chất đó?
Câu 7. Trong nước, ion (ox) thể hiện vai trò phối tử, tạo được hai liên kết với ion Co2+, hình thành phức chất có công thức [Co(ox)(H2O)4].
a) Vẽ cấu trúc hình học của phức chất trên.
b) Cho hằng số cân bằng KC của quá trình tạo phức chất giữa Co2+ với ba anion oxalate là 5,0⋅109:
Co2+(aq) + 3ox [Co(ox)3]2−(aq)
KC = 5,0⋅109
Xét một dung dịch ban đầu chứa ion Co2+ 0,040 M và ion oxalate 0,001 M. Tính nồng độ của ion Co2+ tự do trong dung dịch ở trạng thái cân bằng.
Hướng dẫn
Câu 1.
a) Cấu hình electron:
Ion |
Ti+3 |
Ti+4 |
Cr+2 |
Cr+3 |
Cấu hình electron |
[Ar]3d1 |
[Ar] |
[Ar]3d4 |
[Ar]3d3 |
Ion |
Mn2+ |
Fe3+ |
Cu+1 |
Cu+2 |
Cấu hình electron |
[Ar]3d5 |
[Ar]3d5 |
[Ar]3d10 |
[Ar]3d9 |
b) Các nguyên tử và trạng thái oxi hoá:Mn2+, Fe3+, Cu+.
Câu 2.
– Bán kính nhỏ hơn vì điện tích hạt nhân lớn hơn trong khi số lớp electron ở vỏ nguyên tử như nhau (đều có 4 lớp electron).
– Độ âm điện lớn hơn vì điện tích hạt nhân lớn hơn và bán kính nhỏ hơn ⇒ khả năng hút electron về phía mình lớn hơn.
Độ âm điện lớn hơn cũng dẫn tới hệ quả là tính kim loại yếu hơn.
Câu 3.
a) Nhỏ dung dịch H2SO4 loãng vào thì dung dịch KOH có phenolphthalein sẽ mất màu.
b) Cho vài giọt dung dịch NaOH vào mỗi ống nghiệm chứa khoảng 2 mL dung dịch:
CuSO4 |
FeSO4 |
[Cu(NH3)4](OH)2 |
Kết tủa xanh nhạt |
Kết tủa xanh nhạt rồi hóa nâu trong không khí |
Không xuất hiện kết tủa |
c) Cho vài giọt hồ tinh bột vào mỗi ống nghiệm chứa khoảng 2 mL dung dịch:
FeCl3 |
I2 tan trong KI |
K2CrO4 |
Không |
Chuyển màu đen tím |
Không |
Sau đó, dùng dung dịch NaOH để phân biệt: dung dịch FeCl3 sẽ tạo kết tủa nâu đỏ, còn dung dịch K2CrO4 không có hiện tượng.
Câu 4.
Ion trung tâm |
Công thức phối tử |
Tên phối tử |
Công thức ion phức chất |
Số phối trí |
Điện tích của ion phức chất |
Dạng hình học |
||
Mg2+ |
H2O |
Aqua |
[Mg(H2O)6]2+ |
6 |
+2 |
Bát diện |
||
Ni2+ |
NH3 |
Ammine |
[Ni(NH3)6]2+ |
6 |
+2 |
Bát diện |
||
Cu2+ |
Cl− |
Chloro |
[CuCl4]2− |
4 |
–2 |
Tứ diện |
||
Al3+ |
F− |
Fluoro |
[AlF6]3− |
6 |
–3 |
Bát diện |
||
Ni2+ |
CN− |
Cyano |
[Ni(CN)4]2− |
4 |
–2 |
Vuông phẳng |
||
Al3+ |
OH− |
Hydroxo |
[Al(OH)4]− |
4 |
–1 |
Tứ diện |
||
Fe3+ |
Oxalato (ox) |
[Fe(ox)3]3− |
6 |
–3 |
Bát diện |
|||
Co2+ |
Ethylene dimamine (en) |
[Co(en)3]3+ |
6 |
+3 |
Bát diện |
|||
................................
................................
................................
(Nguồn: NXB Giáo dục)
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Kết nối tri thức năm 2026 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các bài soạn Giáo án Hóa học lớp 12 Kết nối tri thức chuẩn khác:
Giáo án Hóa 12 Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Giáo án Hóa 12 Bài 29: Một số tính chất và ứng dụng của phức chất
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12

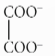
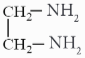



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

