Top 28 Đề kiểm tra Hóa học 9 Học kì 2 có đáp án
Để học tốt Hóa học 9, dưới đây là danh sách Top 28 Đề kiểm tra Hóa học 9 Học kì 2 có đáp án, cực sát đề thi chính thức gồm các đề kiểm tra 15 phút, 45 phút (1 tiết), Đề thi Giữa kì, đề thi học kì 2. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi Hóa học 9.
Đề kiểm tra Hóa học 9 Học kì 2
A/ Đề thi Hóa học 9 theo PPCT
- Đề thi Hóa học 9 Giữa kì 2 năm 2026 có đáp án (3 đề)
- Đề thi Học kì 2 Hóa học 9 năm 2026 có đáp án (5 đề)
B/ Đề thi Hóa học 9 theo Chương
Chương 4: Hidrocacbon - Nhiên liệu
Đề kiểm tra 15 phút
- Đề kiểm tra 15 phút Hóa học 9 Chương 4 có đáp án (Đề 1)
- Đề kiểm tra 15 phút Hóa học 9 Chương 4 có đáp án (Đề 2)
- Đề kiểm tra 15 phút Hóa học 9 Chương 4 có đáp án (Đề 3)
- Đề kiểm tra 15 phút Hóa học 9 Chương 4 có đáp án (Đề 4)
- Đề kiểm tra 15 phút Hóa học 9 Chương 4 có đáp án (Đề 5)
Đề kiểm tra 1 tiết
- Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 4 có đáp án (Đề 4)
Chương 5: Dẫn xuất của hidrocacbon. Polime
Đề kiểm tra 15 phút
- Đề kiểm tra 15 phút Hóa học 9 Chương 5 có đáp án (Đề 1)
- Đề kiểm tra 15 phút Hóa học 9 Chương 5 có đáp án (Đề 2)
- Đề kiểm tra 15 phút Hóa học 9 Chương 5 có đáp án (Đề 3)
- Đề kiểm tra 15 phút Hóa học 9 Chương 5 có đáp án (Đề 4)
- Đề kiểm tra 15 phút Hóa học 9 Chương 5 có đáp án (Đề 5)
Đề kiểm tra 1 tiết
- Đề kiểm tra 1 tiết Hóa học 9 Chương 5 có đáp án (Đề 1)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 5 có đáp án (Đề 2)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 5 có đáp án (Đề 3)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 5 có đáp án (Đề 4)
- Đề kiểm tra 1 tiết Hóa học 9 Chương 5 có đáp án (Đề 5)
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần I: Trắc nghiệm khách quan (3 điểm)
Câu 1: Metan có nhiều trong
A. nước ao. B. các mỏ (khí, dầu, than).
C. nước biển. D. khí quyển.
Câu 2: Hiđrocacbon nào sau đây chỉ có liên kết đơn?
A. Metan. B. Axetilen. C. Etilen. D. Etan.
Câu 3: Dãy chất nào sau đây đều là hiđrocacbon:
A. C2H4, C3H8, C2H4O2, CH3Cl.
B. C3H8, C2H5O, CH3CH2COOH, CaCO3.
C. C2H6, C4H10, CH3NO2, C2H5Cl.
D. CH4, C4H10, C2H2, C2H6.
Câu 4: Phản ứng nào sau đây thuộc loại phản ứng trùng hợp:
A. C2H4 + 3O2 → 2CO2 + 2H2O
B. CH2 = CH2 + Br2 → BrCH2 - CH2Br
C. nCH2 = CH2 → (-CH2-CH2-)n
D. CH4 + Cl2 → CH3Cl + HCl
Câu 5: Đốt cháy hoàn toàn 0,224 lit khí metan ở điều kiện tiêu chuẩn thu được lượng khí CO2 ở cùng điều kiện là:
A. 2,24 lit B. 0,672 lit C. 0,224 lit. D. 0,112 lit
Câu 6: Trong những chất sau, những chất nào đều là chất hữu cơ:
A. C2H6, C2H5OH, NaHCO3.
B. C3H8, C2H5O, Na2CO3.
C. C2H6 , C2H5OH, CaCO3.
D. C2H6 , C4H10, C2H5OH.
Câu 7: Chất có liên kết ba trong phân tử là:
A. CH4. B. C2H4. C. C2H2. D. C2H6.
Câu 8: Cấu tạo phân tử axetilen gồm:
A. hai liên kết đơn và một liên kết ba.
B. hai liên kết đơn và một liên kết đôi.
C. một liên kết ba và một liên kết đôi.
D. hai liên kết đôi và một liên kết ba.
Câu 9: Chất dùng để kích thích cho quả mau chín là:
A. CH4. B. C2H4. C. C2H2. D. C6H6.
Câu 10: Khí metan phản ứng được với:
A. HCl, H2O. B. HCl, Cl2. C. Cl2, O2. D. O2, CO2.
Câu 11: Hóa chất dùng để loại bỏ khí etilen có lẫn trong khí metan để thu được khí metan tinh khiết là
A. dung dịch brom.
B. dung dịch phenolphtalein.
C. dung dịch axit clohidric.
D. dung dịch nước vôi trong.
Câu 12: Dãy chất nào sau đây đều là dẫn xuất của hiđrocacbon?
A. C2H6O, C2H4O2, C6H12O6 . B. C2H4O2, Na2CO3, C2H4.
C. CH4, C2H2, C6H6. D. CO2, CH4, C2H4O2.
Câu 13: Nhóm gồm các chất khí đều khử được CuO ở nhiệt độ cao là
A. CO, H2. B. Cl2, CO2.
C. CO, CO2. D. Cl2, CO.
Câu 14: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là
A. 0,50 lít. B. 0,25 lít.
C. 0,75 lít. D. 0,15 lít.
Câu 15: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 13+, có 3 lớp electron, lớp ngoài cùng có 3 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II. B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II. D. chu kỳ 2, nhóm III.
B. Tự luận: (7,0 điểm)
Câu 1: (2,0 điểm) Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ Metan tác dụng với clo khi có ánh sáng.
b/ Đốt cháy axetilen.
c/ Cho axetilen tác dụng với lượng dư dung dịch brom.
d/ Trùng hợp etilen.
Câu 2: (2,0 điểm) Đốt cháy hoàn toàn 5,6 lít etilen. Hãy tính thể tích khí oxi và thể tích không khí cần dùng cho phản ứng, biết rằng oxi chiếm 20% thể tích không khí (các thể tích khí đo ở đktc).
Câu 3: (3,0 điểm) Khi cho hỗn hợp khí metan và etilen ở (đktc) đi qua bình đựng dung dịch brom, thì lượng brom tham gia phản ứng là 8g.
a/ Khí nào ở trên đã phản ứng với dung dịch brom?
b/ Khối lượng khí đó đã phản ứng là bao nhiêu?
ĐÁP ÁN ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 MÔN Hóa học 9
Phần I. Trắc nghiệm khách quan (3,0 điểm)
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
Đáp án |
B |
A |
D |
C |
C |
D |
C |
A |
B |
C |
A |
A |
A |
B |
B |
Câu 5.
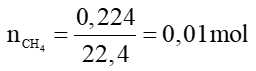
CH4 + 2O2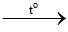 CO2 + 2H2O
CO2 + 2H2O
0,01 0,01 mol
VCO2 = 0,01.22,4 = 0,224 lít.
Câu 6:
Loại A, B, C do các chất NaHCO3; Na2CO3; CaCO3 đều là muối cabonat (thuộc loại hợp chất vô cơ).
Câu 11:
Sử dụng một lượng dư dung dịch brom, khí etilen phản ứng bị giữ lại, còn metan không phản ứng thoát ra khỏi dung dịch thu được metan tinh khiết.
C2H4 + Br2 → C2H4Br2.
Câu 13:
CO + CuO 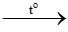 Cu + CO2
Cu + CO2
H2 + CuO 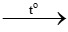 Cu + H2O
Cu + H2O
Câu 14:
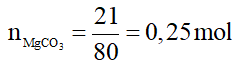
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
0,25 → 0,5 mol
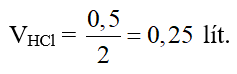
Câu 15:
X có 3 lớp electron → X thuộc chu kì 3;
Lớp ngoài cùng của X có 3 electron → X thuộc nhóm III.
Phần II. Tự luận (7,0 điểm)
Câu 1:
a/ CH4 + Cl2 CH3Cl + HCl
CH3Cl + HCl
b/ 2C2H2 + 5O2 4CO2 + 2H2O
4CO2 + 2H2O
c/ CH ≡ CH + 2Br2 → Br2CH – CHBr2
d/ nCH2 = CH2 ( − CH2 − CH2 − )n
( − CH2 − CH2 − )n
Câu 2:
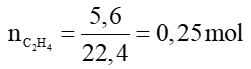
C2H4 + 3O2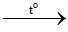 2CO2+ 2H2O
2CO2+ 2H2O
0,25 → 0,75 mol
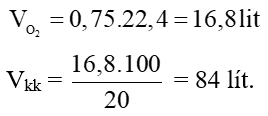
Câu 3:
a/ Khi cho hỗn hợp metan và etilen qua bình đựng dung dịch brom chỉ có etilen phản ứng.
b/ 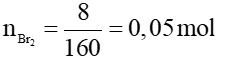
Phương trình hóa học:
C2H4 + Br2 → C2H4Br2
0,05 ← 0,05 mol
Khối lượng etilen: m = 0,05.28 = 1,4 gam.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần tự luận
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án và hướng dẫn giải
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
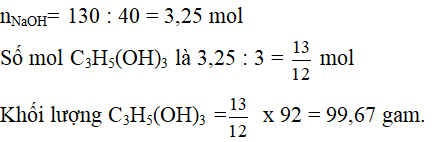
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút chương 4 Học kì 2
Môn: Hóa học 9
Thời gian làm bài: 15 phút
Phần tự luận
Câu 1: (3 điểm) Phát biểu sự biến đổi tính phi kim trong một chu kì và trong nhóm của các nguyên tố hóa học.
Câu 2: (3 điểm) Đốt cháy 4,6 g chất hữu cơ Y thu được 8,8 g CO2 và 5,4 g H2O.
Xác định sự có mặt của các nguyên tố trong Y (H = 1, C = 12, O = 16).
Câu 3: (4 điểm) Khi đốt cháy hào toàn hidrocacbon X sinh ra tỉ lệ số mol CO2 và H2O là 2: 1.
a) Tìm công thức đơn giản nhất của X.
b) Lập công thức phân tử của X. Biết khối lượng mol của X bằng 78 g (H=1, C=12, O=16).
Đáp án và hướng dẫn giải
Câu 1:
Trong một chu kì theo chiều tăng của điện tích hạt nhân, tính phi kim của các nguyên tố tăng dần.
Trong một nhóm theo chiều tăng của điện tích hạt nhân, tính phi kim của các nguyên tố giảm dần.
Câu 2:
mC = 8,8x12/44 = 2,4 gam; mH = 5,4x2/18 = 0,6 gam
mC + mH bé hơn khối lượng chất chất hữu cơ đem phân tích vậy sản phẩm tạo ra có oxi.
Kết luận chất hữu cơ Y có các nguyên tố cacbon, hidro và oxi.
Câu 3:
Tỉ lệ số mol CO2 và H2O là 2: 1 => nC : nH = 1: 1.
a) Công thức đơn giản nhất của X là CH.
b) Công thức phân tử của Y là (CH)n
M = 13n = 78. Suy ra n = 6. Công thức phân tử là C6H6
Xem thêm các đề kiểm tra, đề thi Hóa học 9 chọn lọc, có đáp án hay khác:
Loạt bài Đề thi Hóa lớp 9 năm 2025 học kì 1 và học kì 2 được biên soạn bám sát cấu trúc ra đề thi mới Tự luận và Trắc nghiệm giúp bạn giành được điểm cao trong các bài thi Hóa học lớp 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 9 (các môn học)
- Giáo án điện tử lớp 9 (các môn học)
- Giáo án Toán 9
- Giáo án Ngữ văn 9
- Giáo án Tiếng Anh 9
- Giáo án Khoa học tự nhiên 9
- Giáo án Vật Lí 9
- Giáo án Hóa học 9
- Giáo án Sinh học 9
- Giáo án Địa Lí 9
- Giáo án Lịch Sử 9
- Giáo án GDCD 9
- Giáo án Tin học 9
- Giáo án Công nghệ 9
- Đề thi lớp 9 (các môn học)
- Đề thi Ngữ Văn 9 (có đáp án)
- Đề thi Toán 9 (có đáp án)
- Đề thi Tiếng Anh 9 mới (có đáp án)
- Đề thi Tiếng Anh 9 (có đáp án)
- Đề thi Khoa học tự nhiên 9 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 9 (có đáp án)
- Đề thi GDCD 9 (có đáp án)
- Đề thi Tin học 9 (có đáp án)
- Đề thi Công nghệ 9 (có đáp án)


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



