Giáo án Hóa 12 Kết nối tri thức Bài 18: Cấu tạo và liên kết trong tinh thể kim loại
Giáo án Hóa 12 Kết nối tri thức Bài 18: Cấu tạo và liên kết trong tinh thể kim loại
Chỉ từ 200k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Kết nối tri thức (cả năm) bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: Gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. MỤC TIÊU
1. Kiến thức
- Trình bày được đặc điểm cấu tạo của nguyên tử kim loại và tinh thể kim loại.
- Nêu được đặc điểm của liên kết kim loại.
- Giải thích được một số tính chất vật lí chung của kim loại (tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính ánh kim).
- Trình bày được ứng dụng từ tính chất vật lí chung và riêng của kim loại.
- Trình bày được phản ứng của kim loại với phi kim (chlorine, oxygen, lưu huỳnh) và viết được các PTHH.
2. Về năng lực:
- Sử dụng bảng giá trị thế điện cực chuẩn của một số cặp oxi hoá – khử phổ biến của ion kim loại/kim loại (có bổ sung thế điện cực chuẩn của các cặp H2O/OH− + ½ H2; 2H+/H2) để giải thích được các trường hợp kim loại phản ứng với dung dịch HCl, H2SO4 loãng và đặc; nước; dung dịch muối.
- Thực hiện được một số thí nghiệm của kim loại tác dụng với phi kim, acid (HCl, H2SO4), muối.
3. Về phẩm chất
- Sử dụng tiết kiệm, an toàn các sản phẩm bằng kim loại.
- Trung thực, đoàn kết trong hoạt động nhóm, ghi số liệu thực nghiệm.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hoá chất: magnesium, nhôm, kẽm, đinh sắt, lưu huỳnh, dung dịch H2SO4 10%, dung dịch CuSO4 1 M.
- Dụng cụ: đèn cồn, giá ống nghiệm, đĩa thuỷ tinh, kẹp gỗ, bật lửa.
III. TIẾN TRÌNH DẠY HỌC
1. Hoạt động 1: Mở đầu
1.1. Mục tiêu
- Huy động được vốn hiểu biết, kĩ năng có sẵn của học sinh (về quy luật biến đổi tính chất trong bảng tuần hoàn, thế điện cực chuẩn, điện phân,…) để chuẩn bị cho học bài mới; học sinh cảm thấy vấn đề sắp học rất gần gũi với mình.
- Kích thích sự tò mò, khơi dậy hứng thú của học sinh về chủ đề sẽ học; tạo không khí lớp học sôi nổi, chờ đợi, thích thú.
- Học sinh trải nghiệm qua tình huống có vấn đề, trong đó chứa đựng những nội dung kiến thức, những kĩ năng để phát triển phẩm chất, năng lực mới.
1.2. Nội dung
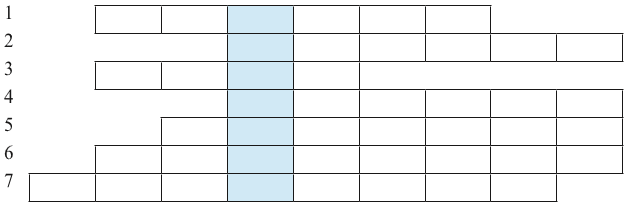
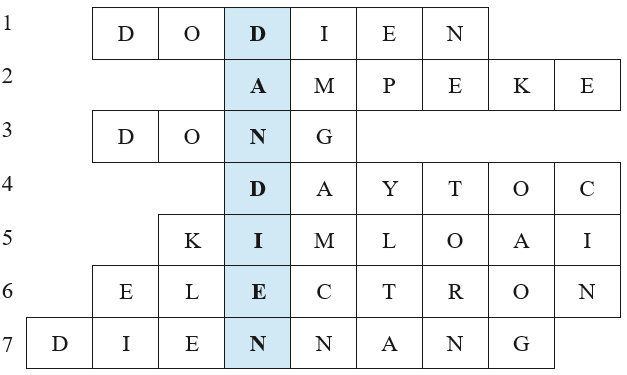
Giáo viên tổ chức cho học sinh trả lời câu hỏi để tìm các từ hàng ngang, cuối cùng xác định từ chìa khoá.
Câu 1: Các thiết bị như bếp điện, tủ lạnh, điều hoà, bình nóng lạnh, nồi cơm điện, máy sấy tóc,... được gọi chung là gì?
Câu 2: Thiết bị nào được dùng để đo cường độ dòng điện?
Câu 3: Kim loại nào thường được dùng để sản xuất dây dẫn, công tắc, cầu dao điện?
Câu 4: Trong bóng đèn sợi đốt, bộ phận nào được làm bằng sợi ωolfram (tungsten)?
Câu 5: Trong bảng tuần hoàn, các nguyên tố loại nào chiếm đa số?
Câu 6: Loại hạt nào mang điện tích âm nhỏ nhất, được chọn làm điện tích đơn vị?
Câu 7: Năng lượng của dòng điện được gọi là gì?
1.3. Sản phẩm
Dẫn điện là tính chất vật lí điển hình của kim loại, được ứng dụng để sản xuất đồ điện gia dụng, dây dẫn điện, thiết bị điện,...
1.4. Tổ chức thực hiện
Giáo viên thiết kế các câu hỏi dạng trò chơi Quizizz, Rung chuông vàng,… để khởi động buổi học.
2. Hoạt động 2: Đặc điểm cấu tạo của nguyên tử kim loại
2.1. Mục tiêu
Trình bày được đặc điểm cấu tạo của nguyên tử kim loại.
2.2. Nội dung
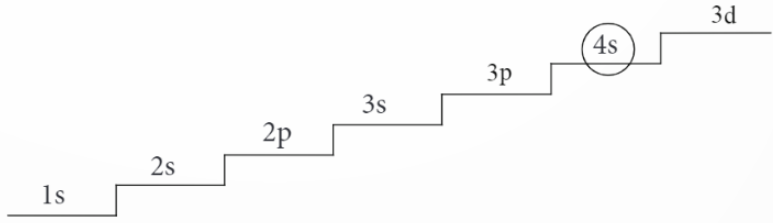
Nhiệm vụ 2.1: Viết cấu hình electron
Bước 1: Điền electron vào các phân lớp theo thứ tự năng lượng từ thấp đến cao:
Bước 2: Viết cấu hình electron
- Z ≤ 20: Thứ tự sắp xếp ở Bước 1 chính là cấu hình electron.
- Z > 20: Sắp xếp lại các phân lớp về đúng trật tự từng lớp.
1. a) Viết cấu hình electron của nguyên tử; xác định vị trí (chu kì, nhóm) của các nguyên tố sau:
Na (Z = 11): …………………………………………………………………..
Al (Z = 13): ……………………………………………………………………
Fe (Z = 26): ……………………………………………………………………
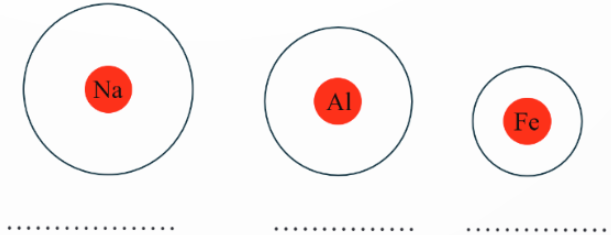
b) Biểu diễn electron lớp ngoài cùng vào mô hình nguyên tử, viết số electron lớp ngoài cùng vào dưới mỗi mô hình:
c) Nhận xét chung về số lượng electron lớp ngoài cùng của các nguyên tử kim loại.
d) So sánh bán kính, độ âm điện của nguyên tử kim loại với nguyên tử phi kim trong cùng chu kì.
e) Từ đặc điểm cấu hình electron lớp ngoài cùng và bán kính nguyên tử, dự đoán xu hướng của các kim loại khi tham gia phản ứng hoá học.
g) Viết quá trình các nguyên tử Na, Al, Fe nhường electron lớp ngoài cùng để trở thành cation kim loại tương ứng.
Nhiệm vụ 2.2: Phân loại nguyên tố kim loại
Ở Bước 1, nếu electron cuối cùng điền vào phân lớp s, p, d hoặc f thì kim loại sẽ thuộc khối s, p, d hoặc f tương ứng.
Các nguyên tố khối s và p sẽ thuộc nhóm A, các nguyên tố d và f sẽ thuộc nhóm B trong bảng tuần hoàn.
1. Xác định các nguyên tố Na, Al, Fe thuộc khối nào và điền vào bảng sau.
Nguyên tố |
Na |
Al |
Fe |
Khối |
2. Dựa vào bảng tuần hoàn, hãy cho biết:
a) Các nguyên tố s, d, f thường là kim loại hay phi kim.
b) Viết kí hiệu các nguyên tố kim loại khối s:
Nhóm IA |
Nhóm IIA |
|
2.3. Sản phẩm
Nhiệm vụ 2.1:
1.
a) Học sinh viết cấu hình electron của nguyên tử; xác định vị trí (chu kì, nhóm) của các nguyên tố:
Na (Z = 11): 1s22s22p63s1 ⇒ chu kì 3, nhóm IA.
Al (Z = 13): 1s22s22p63s23p1 ⇒ chu kì 3, nhóm IIIA.
Fe (Z = 26): 1s22s22p63s23p64s23d6 ⇒1s22s22p63s23p63d64s2
⇒ chu kì 4, nhóm VIIIB.
................................
................................
................................
(Nguồn: NXB Giáo dục)
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 Kết nối tri thức năm 2026 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các bài soạn Giáo án Hóa học lớp 12 Kết nối tri thức chuẩn khác:
Giáo án Hóa 12 Bài 19: Tính chất vật lí và tính chất hoá học của kim loại
Giáo án Hóa 12 Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

