Giáo án Hóa học 12 Bài: Luyện tập: Sự ăn mòn kim loại mới nhất
Với mục đích giúp các Thầy / Cô giảng dạy môn Hóa học dễ dàng biên soạn Giáo án Hóa học lớp 12, VietJack biên soạn Giáo án Hóa học 12 Bài: Luyện tập: Sự ăn mòn kim loại phương pháp mới theo hướng phát triển năng lực theo 5 bước bám sát mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu Giáo án Hóa học 12 này sẽ được Thầy/Cô đón nhận và đóng góp những ý kiến quí báu.
Giáo án Hóa học 12 Bài: Luyện tập: Sự ăn mòn kim loại mới nhất
Chỉ từ 250k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Hóa học 12 theo phương pháp mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
A. CHUẨN KIẾN THỨC – KĨ NĂNG
I. KIẾN THỨC – KĨ NĂNG
1. Kiến thức: Củng cố kiến thức về bản chất của sự ăn mòn kim loại, các kiểu ăn mòn kim loại và chống ăn mòn.
2. Kĩ năng: Kĩ năng tính toán lượng kim loại điều chế theo các phương pháp hoặc các đại lượng có liên quan.
3. Thái độ: Nhận thức được tác hại nghiêm trọng của sự ăn mòn kim loại, nhất là nước ta ở vào vùng nhiệt đới gió mùa, nóng nhiều và độ ẩm cao. Từ đó, có ý thức và hành động cụ thể để bảo vệ kim loại, tuyên truyền và vận động mọi người cùng thực hiện nhiệm vụ này.
II. PHÁT TRIỂN NĂNG LỰC
* Các năng lực chung
1. Năng lực tự học
2. Năng lực hợp tác
3. Năng lực phát hiện và giải quyết vấn đề
4. Năng lực giao tiếp
* Các năng lực chuyên biệt
1. Năng lực sử dụng ngôn ngữ
2. Năng lực tư duy
3. Năng lực giải quyết vấn đề thông qua hóa học
4. Năng lực tính toán
* Phẩm chất: Trung thực, tự trọng, chí công, vô tư; Tự lập, tự tin, tự chủ; Có trách nhiệm với bản thân, cộng đồng, đất nước, nhân loại; Nghĩa vụ công dân.
B. CHUẨN BỊ
* Giáo viên: Lựa chọn bài tập
* Học sinh: Học bài cũ, làm bài tập.
C. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC:
Dạy học hợp tác theo nhóm, đàm thoại
Kĩ thuật khăn trải bàn
D. TIẾN TRÌNH BÀI DẠY
1. Hoạt động khởi động
1.1. Ổn định lớp: Kiểm tra sĩ số, đồng phục...
1.2. Kiểm tra bài cũ: không
2. Hoạt động luyện tập
Hoạt động của giáo viên |
Hoạt động của Học sinh – Phát triển năng lực |
Nội dung |
|
GV chia lớp thành 3 nhóm GV phát phiếu học tập số 1, yêu cầu HS thảo luận Bài 1: Khi điều chế H2 từ Zn và dung dịch H2SO4 loãng, nếu thêm một vài giọt dung dịch CuSO4 vào dung dịch axit thì thấy khí H2 thoát ra nhanh hơn hẳn. Hãy giải thích hiện tượng trên. Bài 2: Ngâm 9g hợp kim Cu – Zn trong dung dịch HCl dư thu được 896 ml H2 (đkc). Xác định % khối lượng của hợp kim. Bài 3: Ngâm 1 cây đinh sắt sạch trong 200ml dd CuSO4. Sau khi kết thúc phản ứng, lấy đinh sắt ra khỏi dd thấy khối lượng đinh sắt tăng 0,8g. Xác định vai trò các chất tham gia phản ứng và nồng độ mol/lit của dd CuSO4. - Gv: Chấm phiếu học tập của một số hs - Gv gọi 3 hs bất kỳ của các nhóm lên bảng, hs khác nhận xét, bổ sung - Gv nhận xét, đánh giá Phiếu số 2. Hoạt động riêng rẽ từng HS |
Hs: thảo luận nhóm hoàn thành 1 trong 3 bài tập trong phiếu (Mỗi học sinh 1 phiếu) Hs: đại diện lên bảng trình bày, hs nhóm khác nhận xét, bổ sung Phát triển năng lực giao tiếp, năng lực tư duy, năng lực phát hiện và giải quyết vấn đề, năng lực tính toán và năng lục sử dụng ngôn ngữ hóa học |
Phiếu học tập số 1 Bài 1: Giải
Zn + H2SO4 → ZnSO4 + H2↑ Khí H2 sinh ra bám vào bề mặt lá Zn, ngăn cản sự tiếp xúc giữa Zn và H2SO4 nên phản ứng xảy ra chậm.
Zn + CuSO4 → ZnSO4 + Cu Cu tạo thành bám vào Fe tạo thành cặp điện cực và Fe bị ăn mòn điện hoá. - Ở cực âm (Fe): Kẽm bị oxi hoá. Zn – 2e → Zn2+ - Ở cực dương (Cu): Các ion H+ của dung dịch H2SO4 loãng bị khử thành khí H2. 2H+ + 2e → H2↑ H2 thoát ra ở cực đồng, nên Zn bị ăn mòn nhanh hơn, phản ứng xảy ra mạnh hơn. Bài 2: Giải Ngâm hợp kim Cu – Zn trong dung dịch HCl dư, chỉ có Zn phản ứng. Zn + 2HCl → ZnCl2 + H2↑ → nZn = nH2 = → %Zn = → %Cu = 71,11% Bài 3: Gọi số mol Fe phản ứng vói x mol. Fe + CuSO4 FeSO4 + Cu → mtăng = 64x - 56x = 8 ↔ x = 1 mol → nCuSO4 = x = 1 mol → CM(CuSO4) = Phiếu học tập số 2 (Nội dung đính kèm bên dưới) |
Xem thêm các bài soạn Giáo án Hóa học lớp 12 theo hướng phát triển năng lực mới nhất, hay khác:
- Giáo án Hóa học 12 Bài: Ôn tập học kì I
- Giáo án Hóa học 12 Bài: Ôn tập học kì I (tiết 2)
- Giáo án Hóa học 12 Bài 21: Điều chế kim loại
- Giáo án Hóa học 12 Bài 21: Điều chế kim loại (tiết 2)
- Giáo án Hóa học 12 Bài 23: Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12

 Ban đầu Zn tiếp xúc trực tiếp với dung dịch H2SO4 loãng và bị ăn mòn hoá học.
Ban đầu Zn tiếp xúc trực tiếp với dung dịch H2SO4 loãng và bị ăn mòn hoá học.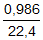 = 0,04
= 0,04 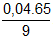 .100 = 28,89%
.100 = 28,89%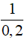 = 5M
= 5M


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

