Nitrogen – sulfur (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Chuyên đề Nitrogen – sulfur có trong bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 đầy đủ lý thuyết và bài tập đa dạng có lời giải giúp học sinh có thêm tài liệu ôn tập cho bài thi tốt nghiệp THPT môn Hóa học.
Nitrogen – sulfur (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Chỉ từ 350k mua trọn bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
I. LÝ THUYẾT TRỌNG TÂM
|
NITROGEN |
SULFUR. SULFUR DIOXIDE |
|
- Nitrogen là nguyên tố phổ biến, góp phần tạo nên sự sống trên Trái Đất. - Cấu hình electron lớp ngoài cùng của nguyên tử N là: 2s22p3. - Số oxi hóa thường gặp của nitrogen: -3, 0, +1, +2, +3, +4, +5. - Phân tử nitrogen gồm 2 nguyên tử liên kết với nhau bằng liên kết ba bền vững (N≡N). - Đơn chất nitrogen khá trơ ở nhiệt độ thường, hoạt động hoá học mạnh hơn khi đun nóng và có xúc tác. - Đơn chất nitrogen thể hiện tính oxi hoá và tính khử. |
Sulfur - Sulfur là nguyên tố phổ biến trên Trái Đất, tồn tại ở cả dạng đơn chất và hợp chất. - Cấu hình electron lớp ngoài cùng: 3s22p4. - Số oxi hoá thường gặp: -2, 0, +4, +6. - Phân tử dạng mạch vòng gồm 8 nguyên tử (S8) và tương đối bền. - Sulfur thể hiện cả tính oxi hoá và tính khử. Sulfur dioxide - Sulfur dioxide phát thải ra môi trường từ quá trình đốt cháy nhiên liệu (than đá, dầu mỏ), đốt cháy sulfur và khoáng vật sulfide,... - Sulfur dioxide có tính chất của oxide acid, có tính oxi hoá và tính khử. |
|
AMMONIA. MUỐI AMMONIUM |
SULFURIC ACID. MUỐI SULFATE |
|
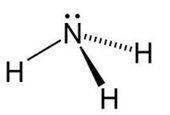
Ammonia - Phân tử ammonia có dạng chóp tam giác, phân tử còn 1 cặp electron không liên kết. - Khí ammonia có mùi khai, dễ tan trong nước, dễ hoá lỏng; ammonia có tính base và tính khử. - Ammonia được sản xuất từ nitrogen và hydrogen theo quá trình Haber - Bosch. Muối ammonium - Muối ammonium thường dễ tan trong nước và kém bền nhiệt. - Ion ammonium được nhận biết bằng phản ứng với kiềm, sinh ra khí có mùi khai. |
Sulfuric acid - Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh. - Dung dịch sulfuric acid đặc có tính háo nước, có khả năng gây bỏng, có tính acid mạnh và tính oxi hoá mạnh. - Bảo quản, sử dụng sulfuric acid đặc phải tuân theo quy tắc đảm bảo an toàn, phòng chống cháy, nổ. - Sulfuric acid được sản xuất từ các nguyên liệu chính: sulfur, quặng pyrite.
Muối sulfate - Các muối sulfate có nhiều ứng dụng thực tiễn: ammonium sulfate, barium sulfate, calcium sulfate, magnesium sulfate,... - Ion sulfate trong dung dịch được nhận biết bằng ion Ba2+. |
|
MỘT SỐ HỢP CHẤT VỚI OXYGEN CỦA NITROGEN |
|
|
Oxide của nitrogen - Các oxide của nitrogen (NOx) là một trong số các tác nhân chính gây ô nhiễm không khí và gây mưa acid. Nitric acid - Nitric acid là chất lỏng, tan tốt trong nước, bốc khói trong không khí ẩm. - Nitric acid có tính acid mạnh và tính oxi hóa mạnh. |
|
|
HIỆN TƯỢNG PHÚ DƯỠNG |
|
|
Hiện tượng phú dưỡng là do sự dư thừa dinh dưỡng (nitrogen và phosphorus) đã cung cấp nguồn thức ăn dồi dào cho sinh vật phù du phát triển mạnh. - Tác hại: + Ngăn cản ánh sáng mặt trời, làm giảm sự quang hợp của thực vật thủy sinh. + Thiếu nguồn oxygen trầm trọng cho tôm, cá, … gây mất cân bằng hệ sinh thái. + Gây ô nhiễm môi trường nước, không khí, tạo bùn lắng xuống ao hồ. - Khắc phục: + Xử lí nước thải trước khi cho thải vào môi trường. + Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm. + Khơi thông kênh rạch, ao hồ, lưu thông dòng nước. |
|
II. CÂU HỎI ÔN LUYỆN
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Câu 1. Trong tự nhiên, nguyên tố nitrogen tồn tại ở dạng nào?
A. Chủ yếu tồn tại dạng NOx trong không khí.
B. Chỉ tồn tại trong các hợp chất.
C. Cả dạng đơn chất và hợp chất.
D. Chủ yếu tồn tại dạng nguyên tử.
Câu 2. Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
Số phản ứng thuộc loại oxi hoá - khử trong sơ đồ là
A. 3.
B. 1.
C. 4.
D. 2.
Câu 3. Hiện tượng phú dưỡng là hệ quả sau khi ao ngòi, sông hồ nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng chứa nguyên tố
A. N và O.
B. N và P.
C. P và O.
D. P và S.
Câu 4. Muối X không tan trong nước và các dung môi hữu cơ. Trong y học, X thường được dùng làm chất cản quang trong xét nghiệm X-quang đường tiêu hóa. Công thức của X là
A. MgSO4.
B. BaSO4.
C. K2SO4.
D. Na2SO4.
Câu 5. Trong cơn giông khi có sấm sét, khí nitrogen (N2) và khí oxygen (O2) trong không khí có thể phản ứng trực tiếp với nhau tạo thành hợp chất nào?
A. N2O5.
B. N2O.
C. NO2.
D. NO.
Câu 6. Nhúng 2 đũa thuỷ tinh vào 2 bình đựng dung dịch HCl đặc và NH3 đặc. Sau đó đưa 2 đũa lại gần nhau thì thấy xuất hiện
A. khói màu nâu.
B. khói màu tím.
C. khói màu trắng.
D. khói màu vàng.
Câu 7. Phát biểu nào sau đây không đúng?
A. Các muối ammonium đều dễ tan trong nước.
B. Dưới tác dụng của nhiệt, các muối ammonium đều bị phân hủy thành ammonia và acid tương ứng.
C. Các muối ammonium khi tan trong nước phân li hoàn toàn thành ion.
D. Có thể dùng muối ammonium để đều chế NH3 trong phòng thí nghiệm.
Câu 8. HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường chuyển sang màu vàng là do
A. HNO3 tan nhiều trong nước.
B. khi để lâu thì HNO3 bị khử bởi các chất của môi trường
C. dung dịch HNO3 tinh khiết có tính oxi hóa mạnh.
D. dung dịch HNO3 có hoà tan một lượng nhỏ NO2 (có màu nâu đỏ).
Câu 9. Vai trò của NH3 trong phản ứng là
A. base.
B. acid.
C. chất oxi hóa.
D. chất khử.
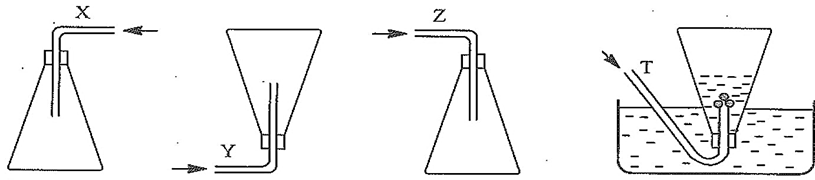
Câu 10. Các chất khí được thu vào bình theo đúng nguyên tắc bằng cách đẩy không khí (X, Y, Z) và đẩy nước (T) như sau:
Nhận xét nào sau đây không đúng?
A. X là nitrogen dioxide.
B. Y là hydrogen.
C. Z là chlorine.
D. T là ammonia.
Câu 11. Kim loại không tan trong dung dịch HNO3 đặc, nguội và H2SO4 đặc, nguội là
A. Ag.
B. Fe.
C. Zn.
D. Cu.
Câu 12. Cho các phát biểu sau:
(a) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(b) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(c) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(d) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2. Ba(OH)2, Ba(NO3)2....
Số phát biểu không đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 13. Mưa acid ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa acid là
A. CO và CH4.
B. CH4 và NH3.
C. SO2 và NO2.
D. CO và CO2.
Câu 14. Tiến hành các thí nghiệm sau: Cho các chất Mg, NaHCO3, BaCl2, CaCO3 vào ống nghiệm chứa dung dịch H2SO4 loãng. Số ống nghiệm xảy ra phản ứng oxi hóa – khử là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 15. Cho phản ứng:
Fe3O4 + HNO3 Fe(NO3)3 + NO + H2O
Hệ số tỉ lượng của HNO3 trong phương trình hoá học trên là (biết hệ số tỉ lượng trong phản ứng là các số nguyên, tối giản)
A. 4.
B. 1.
C. 28.
D. 10.
Câu 16. Trong công nghiệp, quặng pyrite sắt (FeS2) được dùng làm nguyên liệu để
A. tổng hợp dược phẩm.
B. sản xuất sulfuric acid.
C. luyện gang.
D. chế tạo nam châm điện.
Câu 17. Cho các phương trình hóa học sau:
(1)
(2)
Phát biểu nào sau đây đúng?
A. SO2 không thể hiện tính khử và tính oxi hóa.
B. SO2 chỉ thể hiện tính khử.
C. SO2 chỉ thể hiện tính oxi hóa.
D. SO2 vừa thể hiện tính khử, vừa thể hiện tính oxi hóa.
Câu 18. Phát biểu nào sau đây không đúng khi nói về ammonia?
A. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
B. Ammonia có tính acid yếu do nguyên tử nitrogen còn cặp electron hóa trị riêng.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (hay còn gọi là chất sinh hàn).
................................
................................
................................
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Xem thêm các chuyên đề ôn thi tốt nghiệp THPT môn Hóa học năm 2026 có đáp án hay khác:
Chuyên đề: Đại cương về hoá học hữu cơ (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Dẫn xuất halogen - alcohol - phenol (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Hợp chất carbonyl - carboxylic acid (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Cấu tạo nguyên nguyên tử (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Bảng tuần hoàn các nguyên tố hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Liên kết hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

