SO2 + Br2 + H2O → H2SO4 + HBr | SO2 ra H2SO4
Phản ứng SO2 + Br2 + H2O tạo ra H2SO4 và HBr thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về SO2 có lời giải, mời các bạn đón xem:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
1. Phương trình hóa học của phản ứng SO2 tác dụng với Br2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
2. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa – khử:
Chất khử: SO2; chất oxi hóa: Br2
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
- Quá trình oxi hóa:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa
Bước 4: Điền hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
3. Điều kiện để SO2 tác dụng với Br2
- Nhiệt độ thường.
4. Cách tiến hành thí nghiệm
- Sục khí SO2 vào ống nghiệm chứa 1 – 2 mL dung dịch nước brom.
5. Hiện tượng phản ứng
- Dung dịch brom nhạt màu dần đến mất màu.
6. Mở rộng kiến thức về SO2
6.1. Tính chất vật lí
- Là không màu, mùi hắc, nặng hơn không khí (d = )
- Tan nhiều trong nước (ở 20oC, một thể tích nước có thể hòa tan được 40 thể tích SO2).
- Hóa lỏng ở -100C.
- Là khí độc, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp.
6.2. Tính chất hóa học
a. Lưu huỳnh đioxit là acidic oxide
- SO2 tan trong nước tạo thành axit yếu và không bền:
SO2 + H2O ⇆ H2SO3
- SO2 tác dụng với dd bazơ tạo nên 2 loại muối: muối axit HSO3-, muối trung hòa SO32-.
SO2 + NaOH →NaHSO3(1)
SO2 + 2NaOH→ Na2SO3 + H2O (2)
+ Nếu : chỉ xảy ra phản ứng (1)
+ Nếu 1 < < 2: xảy ra cả phản ứng (1) và (2)
+ Nếu : chỉ xảy ra phản ứng (2)
b. Lưu huỳnh đioxit là chất khử và là chất oxi hóa
(*)SO2 là chất khử
Khi gặp chất oxi hóa mạnh như O2 , Cl2 , Br2 : khí SO2 đóng vai trò là chất khử:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
(*) SO2 là chất oxi hoákhi tác dụng chất khử mạnh:
SO2 + 2H2S → 2H2O + 3S
6.3. Ứng dụng và điều chế sulfur dioxide
a. Ứng dụng
- Sản xuất axit sunfuric trong công nghiệp
- Tấy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực, thực phẩm …
b. Điều chế
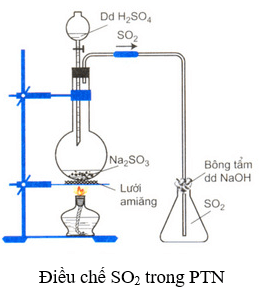
- Trong phòng thí nghiệm:Đun nóng dd H2SO4 với muối Na2SO3, sau đó thu SO2 bằng cách đẩy không khí. Phương trình hóa học:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
- Trong công nghiệp
Đốt cháy S hoặc đốt cháy quặng pirit sắt:
4FeS2 + 11O2 2Fe2O3 + 8SO2
7. Bài tập vận dụng liên quan
Câu 1: Sục một lượng khí SO2 vào dung dịch Ba(OH)2, thu được dung dịch B kết tủa C. Đun nóng dung dịch B lại thấy xuất hiện kết tủa. Dung dịch B tác dụng với Ba(OH)2 sinh ra được kết tủa. Thành phần của dung dịch B là:
A. BaSO3 và Ba(OH)2 dư
B. Ba(HSO3)2
C. Ba(OH)2
D. BaHSO3 và Ba(HSO3)2
Hướng dẫn giải:
Đáp án B
SO2 + Ba(OH)2 → BaSO3 ↓ + H2O
2SO2 + Ba(OH)2 → Ba(HSO3)2
Ba(HSO3)2 BaSO3↓ + SO2 + H2O
Ba(HSO3)2 + Ba(OH)2 → 2BaSO3↓ + 2H2O
Câu 2: Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là:
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Hướng dẫn giải:
Đáp án C
Câu 3: Hấp thụ hoàn toàn 1,12 lít khí SO2 (đktc) vào 150 ml dung dịch NaOH 1M. Cô cạn dung dịch thu được
A. hỗn hợp hai muối NaHSO3, Na2SO3 và NaOH dư
B. Hỗn hợp 2 chất NaOH, Na2SO3
C. Hỗn hợp hai chất SO2 dư, NaOH
D. Hỗn hợp hai muối NaHSO3, Na2SO3
Hướng dẫn giải:
Đáp án B
= 0,05 mol,n NaOH = 0,15 mol
Vì> 2→ chỉ tạo 1 muối là Na2SO3
SO2 + 2 NaOH → Na2SO3 + H2O
0,05 0,15 → 0,05
→ NaOH dư sau phản ứng
→ Dung dịch chứa 2 chất NaOH, Na2SO3
Câu 4: Cho các phản ứng sau:
a) 2SO2 + O2 2SO3
b) SO2 + 2H2S 3S + 2H2O
c) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
d) SO2 + NaOH → NaHSO3
Các phản ứng mà SO2 có tính khử là:
A. a, c, d
B. a,b,d
C. a,c
D. a,d
Hướng dẫn giải:
Đáp án C
a/ 2SO2 + O2 2SO3
c/ SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trong hai phản ứng a và c, số oxi hóa của S trong SO2 tăng từ +4 lên +6 do đó SO2 thể hiện tính khử.
Câu 5: Hóa chất dùng để phân biệt CO2 và SO2 là
A. nước brom
B. Bari hiđroxit
C. phenolphtalein
D. dung dịch nước vôi trong.
Hướng dẫn giải:
Đáp án A
SO2 làm mất màu nước brom còn CO2 thì không
SO2 + Br2+ 2 H2O → 2 HBr + H2SO4
Câu 6: Khí sunfurơ là chất có:
A. Tính khử mạnh.
B. Tính oxi hóa mạnh.
C. Vùa có tính oxi hóa vừa có tính khử.
D. Tính oxi hóa yếu.
Hướng dẫn giải
Đáp án C
Khí sunfurơ là SO2.
Trong SO2, lưu huỳnh có số oxi hóa +4 là số oxi hóa trung gian nên SO2 vừa có tính oxi hóa và tính khử.
Câu 7: SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, nước Br2, O2
B. dung dịch NaOH, O2, dung dịch KMnO4
C. dung dịch KOH, CaO, nước Br2
D. O2, nước Br2, dung dịch KMnO4
Hướng dẫn giải:
Đáp án D
A loại H2S vì H2S là chất có tính khử nên khi phản ứng với H2S thì SO2 thể hiện tính oxi hóa.
B loại NaOH vì phản ứng giữa SO2 và NaOH không phải là phản ứng oxi hóa khử
C loại KOH vì phản ứng giữa SO2 và KOH không phải là phản ứng oxi hóa khử
D đúng
Các phản ứng là:
2SO2 + O2 2SO3
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Câu 8: Hấp thụ hoàn toàn 2,24 lít khí SO2 (đkc) vào 100 ml dung dịch NaOH 1,5M. Muối thu được gồm:
A. Na2SO4
B. NaHSO3
C. Na2SO3
D. NaHSO3 và Na2SO3
Hướng dẫn giải:
Đáp án D
Ta có:
Nên muối thu được gồm: NaHSO3 và Na2SO3
Câu 9: Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
A. 47, 92%
B. 42, 96%
C. 42,69%
D. 24,97%
Hướng dẫn giải:
Đáp án B
; nNaOH = = 0,4 mol
2H2S + 3O2 → 2SO2+ 2H2O
Ta thấy: Tạo muối axit: NaOH + SO2 →NaHSO3
Theo PTHH:
→ mdd sau= 50.1,28 + 0,4.64 + 0,4.18 = 96,8g
→
Câu 10:Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 5,6 lít khí SO2 (đkc) là:
A. 250 ml
B. 500 ml
C. 125 ml
D. 175 ml
Hướng dẫn giải:
Đáp án C
Vì NaOH tối thiểu cần dùng nên chỉ xảy ra phản ứng tạo NaHSO3 (tỉ lệ NaOH : SO2 =1:1)
NaOH + SO2 → NaHSO3
Vdd NaOH = 0,125 (lít) = 125 (ml)
Câu 11: Đốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Khối lượng kết tủa thu được là:
A. 10,85 gam
B. 16,725 gam
C. 21,7 gam
D. 32,55 gam
Hướng dẫn giải:
Đáp án A
nS = 0,15 (mol)
S + O2 SO2
Theo PTHH:
Ta có tỉ lệ:
→ Thu được 2 muối: BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 → BaSO3 + H2O
x →x→x (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y→y→ y (mol)
Ta có hệ phương trình:
Giải hệ phương trình
Vậy
Câu 12:Hòa tan 8,36g oleum vào nước được dung dịch Y, để trung hòa dung dịch Y cần 200 ml dung dịch NaOH 1M. Công thức phân tử của oleum:
A. H2SO4. nSO3
B. H2SO4.3SO3
C. H2SO4. 5SO3
D. H2SO4. 4SO3
Hướng dẫn giải:
Đáp án D
Gọi công thức phân tử của oleum là: H2SO4.nSO3
H2SO4.nSO3 + nH2O → (n+1) H2SO4 (1)
← 0,1 mol
Dung dịch Y là dung dịch H2SO4
H2SO4 + 2 NaOH → Na2SO4 + 2H2O (2)
0,1 mol ← 0,2 mol
→ n = 4 → CTPT của oleum: H2SO4.4SO3
Xem thêm các phương trình hóa học hay khác:
- H2S + CuSO4 → CuS↓ + H2SO4
- H2S + H2SO4 đậm đặc → SO2↑+ 2H2O + S↓
- 2H2S + 3O2 2SO2↑ + 2H2O
- H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
- S + O2 SO2
- H2S + 2NaOH → Na2S + 2H2O
- S + 6HNO3 → H2SO4 + 6NO2↑+ 2H2O
- H2S + NaOH → NaHS + H2O
- S + 2H2SO4 đặc 3SO2↑+ 2H2O
- 3H2S + 2HNO3 → 4H2O + 2NO↑ + 3S↓
- S + H2 H2S
- SO2 + Na2O Na2SO3
- SO2 + 2KOH → K2SO3 + H2O
- SO2 + H2S → 3S↓ + 2H2O
- 2SO2 + 2NaH → H2S↑ + Na2SO4
- SO2 + Cl2 + 2H2O → 2HCl + H2SO4
- 2SO2 + O2 2SO3
- 2SO2 + O2 + 2H2O → 2H2SO4
- 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
- SO3 + H2O → H2SO4
- H2S + 2FeCl3 → S↓ + 2FeCl2 + 2HCl
- 3H2S + 2KMnO4 → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
- H2S + 4Br2 + 4H2O → 8HBr + H2SO4
- SO2 + Ca(OH)2 → CaSO3↓ + H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



