Đề kiểm tra 15 phút Hóa 11 Học kì 1 có đáp án (Bài số 2) (3 đề)
Đề kiểm tra 15 phút Hóa 11 Học kì 1 có đáp án (Bài số 2) (3 đề)
Dưới đây là danh sách Đề kiểm tra 15 phút Hóa 11 Học kì 1 có đáp án (Bài số 2) (3 đề). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện & đạt điểm cao trong các bài thi Hóa học 11.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 1
Môn: Hóa học 11
Thời gian làm bài: 15 phút
(Đề 1)
Câu 1: Phân bón nào sau đây làm tăng độ chua của đất?
A. KCl.
B. NH4NO3.
C. NaNO3.
D. K2CO3.
Câu 2: Chất nào sau đây không bị hòa tan trong dung dịch NH3?
A. Al(OH)3.
B. Cu(OH)2.
C. AgCl.
D. Zn(OH)2.
Câu 3: Cho phương trình : 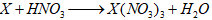
A. FeO hoặc Fe(OH)2.
B. Fe3O4 hoặc FeO.
C. Fe(OH)3 hoặc Fe2O3.
D. Fe hoặc Fe(OH)2.
Câu 4: Khi cho Fe tác dụng với dung dịch HNO3, thu được Fe(NO3)2 cần cho:
A. Fe dư.
B. HNO3 dư.
C. HNO3 loãng.
D. HNO3 đặc.
Câu 5: Trong phương trình hóa học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số cân bằng (là các số nguyên, tối giản) là
A. 5.
B. 7.
C. 9.
D. 21.
Câu 6: Có thể phân biệt muối amoni với các muối khác, nhờ phản ứng với dung dịch kiềm mạnh, đun nóng. Khi đó, từ ống nghiệm đựng muối amoni sẽ thấy:
A. muối nóng chảy ở nhiệt độ không xác định.
B. thoát ra chất khí có màu đỏ.
C. thoát ra chất khí không màu, có mùi khai.
D. thoát ra chất khí không màu, không mùi
Câu 7: Cho 200ml dung dịch H3PO4 1,5M tác dụng với 200ml dung dịch NaOH 2M. Muối thu được sau phản ứng là
A. NaH2PO4 và Na2HPO4.
B. Na2HPO4 và Na3PO4.
C. NaH2PO4 và Na3PO4.
D. NaHPO4.
Câu 8: Cho hỗn hợp các chất của nitơ sau: (1) NH3, (2) N2, (3) N2O, (4) NO, (5) N2O5, (6) NO2, (7) HNO3. Xác định công thức đúng lần lượt của X, Y, Z trong dãy chuyển hóa sau:
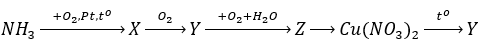
A. 4, 3, 7.
B. 4, 6, 7.
C. 5, 1, 7.
D. 2, 6, 7.
Câu 9: Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
A. FeO, NO.
B. Fe2O3, NO2 và O2 .
C. FeO, NO2 và O2.
D. FeO, NO và O2.
Câu 10. Cho 17,4g FeCO3 tác dụng với dung dịch HNO3 dư thu được V lít khí (đktc, NO là sản phẩm khử duy nhất). Giá trị của V là
A. 4,48.
B. 5,6.
C. 6,72.
D. 8,96.
Đáp án & Hướng dẫn giải
Câu 1. B
NH4+ + H2O → NH3 + H3O+
Khi tan trong nước muối amoni bị thủy phân tạo môi trường axit nên làm tăng độ chua của đất.
Câu 2. A
Cu(OH)2; Zn(OH)2; AgCl bị hòa tan trong dung dịch NH3
Cu(OH)2↓ + 4NH3 → [Cu(NH3)4](OH)2
Zn(OH)2↓ + 4NH3 → [Zn(NH3)4](OH)2
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl.
Câu 3. C
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Câu 4. A
Fe + HNO3 → Fe(NO3)3 + sản phẩm khử + H2O
Fedư + 2Fe(NO3)3 → 3Fe(NO3)2.
Câu 5. D
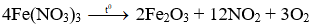
Tổng hệ số: 4 + 2 + 12 + 3 = 21.
Câu 6. C
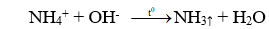
NH3: khí không màu, mùi khai.
Câu 7. A
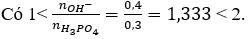
Vậy sau phản ứng thu được 2 muối NaH2PO4 và Na2HPO4.
Câu 8. B
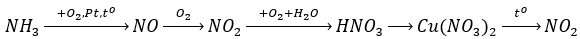
Vậy X là NO (4); Y là NO2 (6); Z là HNO3 (7).
Câu 9. B
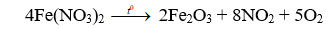
Câu 10. A
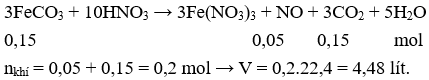
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 1
Môn: Hóa học 11
Thời gian làm bài: 15 phút
(Đề 2)
Câu 1: Trong phòng thí nghiệm, thường điều chế HNO3 bằng phản ứng:
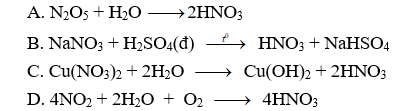
Câu 2: Trong phản ứng hóa học giữa Ca và P, P đóng vai trò
A. vừa là chất oxi hóa vừa là chất khử.
B. không đó vai trò oxi hóa hay khử.
C. là chất oxi hóa.
D. là chất khử.
Câu 3: Axit H3PO4 và HNO3 cùng phản ứng được với tất cả các chất trong dãy
A. MgO, BaSO4, NH3, Ca(OH)2.
B. NaOH, KCl, NaHCO3, H2S.
C. CuCl2, KOH, NH3, Na2CO3.
D. KOH, NaHCO3, NH3, CaO.
Câu 4: Khí amoniac làm quỳ tím ẩm chuyển sang màu
A. xanh.
B. đỏ.
C. tím.
D. không màu.
Câu 5: Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H3PO4 1,5M. Muối tạo thành có khối lượng tương ứng là
A. 28,4g Na2HPO4 và 16,4g Na3PO4
B. 24,0g NaH2PO4 và 14,2g Na2HPO4
C. 12,0g NaH2PO4 và 28,4g Na2HPO4
D. 14,2g Na2HPO4 và 32,8g Na3PO4
Câu 6. Từ 34 tấn NH3 sản xuất 160 tấn dung dịch HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là
A. 80%.
B. 50%.
C. 60%.
D. 85%.
Câu 7: Cho hỗn hợp gồm 0,2 mol Fe và 0,3 mol Mg vào dung dịch HNO3 dư thu được 0,4 mol một sản phẩm khử chứa N duy nhất. Sản phẩm đó là
A. N2O.
B. NO.
C. NO2.
D. NH4NO3.
Câu 8: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3, FeS, FeS2 lần lượt phản ứng với HNO3 đặc nóng. Số phản ứng thuộc loại phản ứng oxi hóa – khử là
A. 9.
B. 8.
C. 10.
D. 7.
Câu 9: Photpho hoạt động hơn so với nitơ do
A. photpho có độ âm điện nhỏ hơn nitơ.
B. photpho có độ âm điện lớn hơn nitơ.
C. photpho có hai dạng thù hình.
D. photpho có độ âm điện nhỏ hơn nitơ nhưng do liên kết kém bền so với liên kết N ≡ N.
Câu 10: HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
A. Fe(OH)3, Na2CO3, Fe3O4, FeCO3
B. CaCO3, Cu(OH)2, Fe(OH)2, FeS
C. CuO, NaOH, MgCO3, Fe2O3
D. KOH, FeS, K2CO3, CuS, C
Đáp án & Hướng dẫn giải
Câu 1. B
Trong phòng thí nghiệm, axit HNO3 được điều chế bằng cách cho NaNO3 hoặc KNO3 tác dụng với axit H2SO4 đặc, nóng.
Câu 2. C
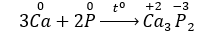
P có số oxi hóa giảm từ 0 xuống – 3 sau phản ứng nên là chất oxi hóa.
Câu 3. D
A sai do BaSO4 không phản ứng với H3PO4 và HNO3.
B sai do H2S; KCl không tác dụng với H3PO4…
C sai do CuCl2 không tác dụng với HNO3 …
Câu 4. A
Khí amoniac làm xanh giấy quỳ tím ẩm do:
NH3 + H2O ⇌ NH4+ + OH-
Câu 5. C
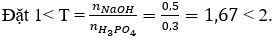
Vậy sau phản ứng thu được hai muối NaH2PO4 (x mol) và Na2HPO4 (y mol)
Bảo toàn P có: x + y = 0,3
Bảo toàn Na có: x + 2y = 0,5
Giải hệ phương trình được x = 0,1 và y = 0,2.
Vậy khối lượng hai muối NaH2PO4 và Na2HPO4 lần lượt là 12 gam và 28,4 gam.
Câu 6. A
Ta có khối lượng HNO3 thực tế thu được là:
mtt = mHNO3 = 160.63% = 100,8 tấn.
Sơ đồ điều chế HNO3 từ NH3
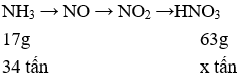
Lượng HNO3 thu được theo lý thuyết là: mlt = x = (34.63):17=126 tấn.
Hiệu suất của phản ứng là 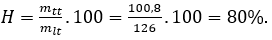
Câu 7. B
Bảo toàn electron có:
3.nFe + 2.nMg = n.nkhí → n = 3 (Với n là số electron nhận)
Vậy khí là NO.
Câu 8. A
Khi HNO3 đặc, nóng phản ứng với các chất sau: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3, FeS, FeS2 thì phản ứng thuộc loại phản ứng oxi hóa – khử.
Câu 9. D
Câu 10. C
CuO + 2HNO3 → Cu(NO3)2 + H2O
NaOH + HNO3 → NaNO3 + H2O
MgCO3 + 2HNO3 → Mg(NO3)2 + CO2 + H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 1
Môn: Hóa học 11
Thời gian làm bài: 15 phút
(Đề 3)
Câu 1. Không khí trong phòng thí nghiệm bị ô nhiễm bởi khí clo. Để khử độc, có thể xịt vào không khí dung dịch nào sau đây?
A. Dung dịch NaOH.
B. Dung dịch NH3.
C. Dung dịch NaCl.
D. Dung dịch H2SO4 loãng.
Câu 2. Phát biểu sai là
A. Các muối amoni đều dễ tan trong nước.
B. Các muối amoni khi tan trong nước đều điện li hoàn toàn thành ion.
C. Các muối amoni khi đun nóng đều bị phân hủy thành amoniac và axit tương ứng.
D. Có thể dùng muối amoni để đều chế NH3 trong phòng thí nghiệm.
Câu 3. Nhận xét nào sau đây là sai?
A. Axit photphoric là chất tinh thể trong suốt, rất háo nước.
B. Axit photphoric tan trong nước theo bất kỳ tỉ lệ nào.
C. Axit photphoric thường dùng là dung dịch đặc, sánh, có nồng độ 85%.
D. Dung dịch axit photphoric 85% có màu nâu đỏ.
Câu 4. Thuốc thử dùng để nhận biết ion PO43- trong dung dịch muối photphat là
A. quỳ tím.
B. Dung dịch NaOH.
C. Dung dịch AgNO3.
D. Dung dịch NaCl.
Câu 5. Trong những nhận xét dưới đây về muối nitrat của kim loại, nhận xét sai là
A. Tất cả các muối nitrat đều dễ tan trong nước.
B. Các muối nitrat là chất điện li mạnh, trong dung dịch loãng chúng phân li hoàn toàn thành các ion.
C. Các muối nitrat dễ bị nhiệt phân hủy.
D. Các muối nitrat chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
Câu 6. Cho 25,2 gam Fe tác dụng với HNO3 loãng, đun nóng thu được khí NO là sản phẩm khử duy nhất và một dung dịch Z, còn lại 1,4 gam kim loại không tan. Khối lượng muối trong dung dịch Z là
A. 76,5 gam.
B. 82,5 gam.
C. 126,2 gam.
D. 180,2 gam.
Câu 7. Chất nào sau đây không phải là đạm amoni?
A. NH4Cl.
B. NH4NO3.
C. (NH4)2SO4.
D. NaNO3.
Câu 8. Vị trí của P (z = 15) trong bảng tuần hoàn các nguyên tố hóa học là
A. ô 15, chu kỳ 2, nhóm VA.
B. ô 15, chu kỳ 3, nhóm VA.
C. ô 15, chu kỳ 2, nhóm IIIA.
D. ô 15, chu kỳ 3, nhóm IIIA.
Câu 9. Khi tham gia phản ứng hóa học, P thể hiện tính chất nào sau đây?
A. Tính oxi hóa.
B. Tính khử.
C. Vừa có tính oxi hóa, vừa có tính khử.
D. Tính kim loại.
Câu 10. Cho V lít (đktc) hỗn hợp khí N2 và H2 có tỉ lệ mol 1:4 vào bình kín và nung nóng. Sau phản ứng thu được 1,5 mol NH3. Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít.
B. 268,8 lít.
C. 336 lít.
D. 448 lít.
Đáp án & Hướng dẫn giải
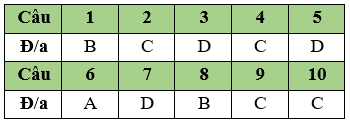
Câu 1. B
Cl2 oxi hóa mạnh amoniac tạo ra N2 và HCl.
2NH3 + 3Cl2 → N2 + 6HCl.
Câu 2. C
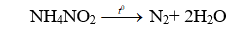
Câu 3. D
Dung dịch axit photphoric 85% không màu.
Câu 4. C
PO43- + 3Ag+ → Ag3PO4 (↓ vàng)
Câu 5. D
Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học trong nông nghiệp, ngoài ra còn được sử dụng làm thuốc nổ đen...
Câu 6. A
Do sau phản ứng vẫn còn kim loại nên sau phản ứng chỉ thu được muối Fe(NO3)2.
Bảo toàn nguyên tố Fe có nmuối = nFe phản ứng = (25,2 - 1,4) : 56 = 0,425 mol
mmuối = 0,425.(56 + 62.2) = 76,5 gam.
Câu 7. D
NaNO3 thuộc đạm nitrat.
Câu 8. B
P (z = 15): 1s22s22p63s23p3
P thuộc ô 15 (do z = 15), chu kỳ 3 (do có 3 lớp electron), nhóm VA (do 5 electron lớp ngoài cùng, nguyên tố p).
Câu 9. C
Trong hợp chất, P có các số oxi hóa -3, +3, +5. Do đó, khi tham gia phản ứng hóa học P vừa thể hiện tính oxi hóa, vừa thể hiện tính khử.
Câu 10. C
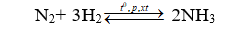
Giả sử phản ứng xảy ra với H = 100% → N2 hết →Hiệu suất tính theo N2.
Đặt số mol N2 ban đầu là x mol, nH2 ban đầu = 4x mol;
Do hiệu suất phản ứng là 25% nên nN2 pứ = 25%.x = 0,25x mol
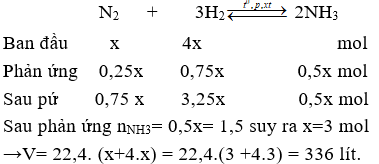
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 1
Môn: Hóa học 11
Thời gian làm bài: 15 phút
(Đề 4)
Câu 1. Nhận xét đúng về muối amoni là
A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion hidroxit.
B. Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
Câu 2. Dung dịch amoniac có tính bazơ do
A. Amoniac tan nhiều trong nước.
B. Phân tử amoniac là phân tử có cực.
C. Khi tan trong nước, amoniac kết hợp với nước tạo ra các ion NH4+ và H3O+.
D. Khi tan trong nước, các phân tử amoniac kết hợp với ion H+ của nước tạo ra các ion NH4+ và OH-.
Câu 3. Trong công nghiệp, để điều chế H3PO4 có độ tinh khiết và nồng độ cao người ta thường
A. cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit.
B. cho P tác dụng với HNO3 đặc.
C. đốt cháy P thu P2O5 rồi cho P2O5 tác dụng với H2O.
D. nung hỗn hợp Ca3(PO4)2, SiO2, C.
Câu 4. Cho 3,92 gam H3PO4 vào dung dịch chứa 4,4 gam NaOH. Số mol muối tạo thành là
A. 0,01 và 0,03.
B. 0,02 và 0,03.
C. 0,01 và 0,02.
D. đáp án khác.
Câu 5. Phát biểu sai là
A. Muối nitrat được sử dụng chủ yếu để làm phân đạm trong nông nghiệp.
B. Nhiều chất hữu cơ bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
C. HNO3 là một axit mạnh, có tính oxi hóa mạnh.
D. HNO3 đặc khi tác dụng với C, S, P nó khử các phi kim đến mức oxi hóa cao nhất.
Câu 6. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là
A. 18,90 gam.
B. 37,80 gam.
C. 39,80 gam.
D. 28,35 gam.
Câu 7. Phân supephotphat kép thực tế sản xuất được thường chỉ có 40% P2O5. Vậy % khối lượng Ca(H2PO4)2 trong phân bón đó là
A. 78,56%.
B. 56,94%.
C. 65,92%.
D. 75,83%.
Câu 8. Trong các nguồn sau, nguồn chứa nhiều photpho trong tự nhiên là
A. quặng apatit.
B. quặng xiđerit.
C. cơ thể người và động vật.
D. protein thực vật.
Câu 9. Đốt cháy P trong điều kiện thiếu oxi thu được sản phẩm là
A. PO.
B. P2O.
C. P2O3.
D. P2O5.
Câu 10. Phương pháp chủ yếu sản xuất N2 trong công nghiệp là
A. chưng cất phân đoạn không khí lỏng.
B. nhiệt phân muối NH4NO3.
C. phân hủy protein.
D. tất cả đều đúng.
Đáp án & Hướng dẫn giải
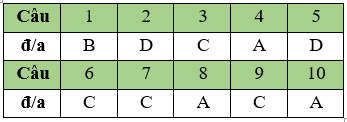
Câu 1. B.
Câu 2. D.
Câu 3. C
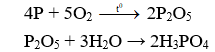
Câu 4. A
nNaOH = 0,11 mol, naxit = 0,04 mol
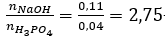
Bảo toàn Na có: 2x + 3y = 0,11
Bảo toàn P có: x + y = 0,04
→ x = 0,01 và y = 0,03.
Câu 5. D
HNO3 đặc khi tác dụng với C, S, P nó oxi hóa các phi kim đến mức oxi hóa cao nhất.
Câu 6. C
nZn = 0,2 mol; nN2 = 0,02 mol.
Giả sử sản phẩm khử sinh ra chỉ có N2. Ta có nZn.2 = 0,4 ≠ nN2.10 = 0,2.
Vậy còn có sản phẩm khử là NH4NO3 x mol
Áp dụng định luật bảo toàn electron có: nZn.2 = nN2.10 + nNH4NO3.8
→ nNH4NO3 = 0,025 mol.
Muối trong X gồm Zn(NO3)2 và NH4NO3.
Bảo toàn nguyên tố Zn có nZn(NO3)2 = nZn = 0,2
→ mmuối = 0,2.(65 + 62.2) + 0,025.(18 + 62) = 39,80 gam.
Câu 7. C
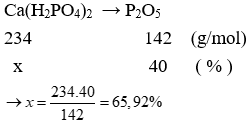
Câu 8. A
Hai khoáng vật chính của photpho là photphorit và apatit.
Câu 9. C
4P + 3O2 (thiếu) → 2P2O3
Câu 10. A
Phương pháp chủ yếu sản xuất N2 trong công nghiệp là chưng cất phân đoạn không khí lỏng.
Xem thêm các đề thi Hóa học 11 chọn lọc, có đáp án hay khác:
- Đề kiểm tra 15 phút Hóa 11 Học kì 1 có đáp án (Bài số 1) (5 đề)
- Đề kiểm tra Hóa học 11 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 11 Giữa kì 1 có đáp án (3 đề)
- Đề thi Hóa học 11 Học kì 1 có đáp án (9 đề)
- Đề kiểm tra 15 phút Hóa 11 Học kì 2 có đáp án (Bài số 1) (8 đề)
Để học tốt lớp 11 các môn học sách mới:
- Giải bài tập Lớp 11 Kết nối tri thức
- Giải bài tập Lớp 11 Chân trời sáng tạo
- Giải bài tập Lớp 11 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 11 (các môn học)
- Giáo án điện tử lớp 11 (các môn học)
- Giáo án Toán 11
- Giáo án Ngữ văn 11
- Giáo án Tiếng Anh 11
- Giáo án Vật Lí 11
- Giáo án Hóa học 11
- Giáo án Sinh học 11
- Giáo án Lịch Sử 11
- Giáo án Địa Lí 11
- Giáo án KTPL 11
- Giáo án HĐTN 11
- Giáo án Tin học 11
- Giáo án Công nghệ 11
- Giáo án GDQP 11
- Đề thi lớp 11 (các môn học)
- Đề thi Ngữ Văn 11 (có đáp án)
- Chuyên đề Tiếng Việt lớp 11
- Đề cương ôn tập Văn 11
- Đề thi Toán 11 (có đáp án)
- Đề thi Toán 11 cấu trúc mới
- Đề cương ôn tập Toán 11
- Đề thi Tiếng Anh 11 (có đáp án)
- Đề thi Tiếng Anh 11 mới (có đáp án)
- Đề thi Vật Lí 11 (có đáp án)
- Đề thi Hóa học 11 (có đáp án)
- Đề thi Sinh học 11 (có đáp án)
- Đề thi Lịch Sử 11
- Đề thi Địa Lí 11 (có đáp án)
- Đề thi KTPL 11
- Đề thi Tin học 11 (có đáp án)
- Đề thi Công nghệ 11
- Đề thi GDQP 11 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

