Giáo án Chuyên đề Hóa học 12 Chân trời sáng tạo Bài 7: Liên kết và cấu tạo của phức chất
Giáo án Chuyên đề Hóa học 12 Chân trời sáng tạo Bài 7: Liên kết và cấu tạo của phức chất
Chỉ từ 250k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án Chuyên đề học tập Hóa 12 Chân trời sáng tạo bản word chuẩn kiến thức, trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. MỤC TIÊU
1. Kiến thức
- Sự hình thành liên kết trong phức chất theo thuyết Liên kết hóa trị áp dụng cho phức chất tứ diện và bát diện.
- Các dạng hình học của một số phức chất đơn giản.
- Đồng phân cơ bản của phức chất: đồng phân cis-trans, đồng phân ion hóa, đồng phân liên kết.
2. Năng lực
2.1. Năng lực chung
- Tự chủ và tự học: Chủ động, tích cực tìm hiểu về thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất tứ diện và bát diện, cách biểu diễn dạng hình học, cách viết một số loại đồng phân cơ bản của phức chất.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất tứ diện và bát diện, cách biểu diễn dạng hình học, cách viết một số loại đồng phân cơ bản của phức chất; hoạt động nhóm và cặp đôi một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học để hoàn thành nhiệm vụ học tập.
2.2. Năng lực hóa học
- Nhận thức hoá học: Trình bày được thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất tứ diện và bát diện; biểu diễn được dạng hình học của một số phức chất đơn giản, viết được một số loại đồng phân cơ bản của phức chất.
- Tìm hiểu thế giới tự nhiên dưới góc độ hoá học: Thu thập thông tin về các phức chất trong tự nhiên và trong cuộc sống để tìm hiểu vai trò và ứng dụng của chúng.
- Vận dụng kiến thức, kĩ năng đã học: Vận dụng các kiến thức cơ bản về phức chất để giải thích được một số vấn đề trong cuộc sống.
3. Phẩm chất
- Tham gia tích cực hoạt động nhóm và cặp đôi phù hợp với khả năng của bản thân.
- Yêu quý thiên nhiên và sử dụng hợp lí các sản phẩm chứa phức chất.
- Có niềm say mê, hứng thú với việc khám phá và học tập hoá học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Mô hình các phức chất dạng tứ diện, bát diện.
- Phiếu học tập 1, 2, 3, 4.
- Video thí nghiệm: Phản ứng tráng bạc của aldehyde acetic và phức [Ag(NH3)2]OH
https://www.youtube.com/watch?v=oYPIGmvkyeQ
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu:
Khơi gợi kiến thức, ôn lại những khái niệm cơ bản của phức chất, tạo tâm thế hứng thú cho học sinh và từng bước làm quen bài mới.
b) Nội dung:
GV nêu vấn đề: quan sát video về phản ứng tráng bạc của aldehyde acetic và phức [Ag(NH3)2]OH trả lời các câu hỏi:
+ Hãy cho biết nguyên tử trung tâm và phối tử trong phức [Ag(NH3)2]OH?
+ Xác định số phối trí của nguyên tử trung tâm trong phức [Ag(NH3)2]OH và giải thích?
GV dẫn dắt HS vào vài mới: Để tìm hiểu rõ hơn về cấu tạo và sự hình thành liên kết trong phức chất chúng ta cùng đi vào bài “Liên kết và cấu tạo của phức chất”.
c) Sản phẩm:
HS trả lời:
+ Trong phức chất [Ag(NH3)2]OH nguyên tử trung tâm là cation Ag+, phối tử là phân tử NH3.
+Trong phức chất [Ag(NH3)2]OH số phốu trí của nguyên tử trung tâm là 2 vì 2 phối tử NH3 đã tạo 2 liên kết với nguyên tử trung tâm Ag+.
d) Tổ chức thực hiện: Từng HS quan sát và trả lời câu hỏi GV.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
|
Hoạt động 1:Mô tả sự hình thành liên kết trong phức chất tứ diện Mục tiêu: – Trình bày được sự hình thành liên kết trong phức chất tứ diện. – Thông qua việc hình thành kiến thức mới, HS phát triển được các năng lực chung và năng lực đặc thù. |
|
|
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|
Giao nhiệm vụ học tập: - GV yêu cầu các nhóm HS tìm hiểu thông tin trong SCĐ, làm việc nhóm để trả lời câu Thảo luận 1 trong SCĐ và các yêu cầu khác của GV: 1. Hãy cho biết số phối trí của nguyên tử trung tâm và dung lượng phối trí của phối tử trong phức chất được nêu ở các ví dụ 1 và 2. - Kết quả câu trả lời của HS được trình bày trong Phiếu học tập số 1. Qua đó biết được cách mô tả sự hình thành liên kết trong phức chất tứ diện theo thuyết Liên kết hoá trị. - GV yêu cầu HS làm việc theo cặp đôi thảo luận đưa ra trả lời cho câu Luyện tập trong SCĐ. * Mô tả sự hình thành liên kết trong ion phức tứ diện [Zn(OH)4]2–. - Kết quả câu trả lời của HS được trình bày trong Phiếu học tập số 1. Thực hiện nhiệm vụ: - HS thảo luận theo nhóm được phân công và đưa ra câu trả lời theo mẫu trong Phiếu học tập số 1. - GV theo dõi và động viên, khích lệ HS đưa ra câu trả lời. Báo cáo, thảo luận: GV thu phiếu học tập, sử dụng phương pháp đánh giá đồng đẳng chéo giữa các nhóm, đưa ra thang điểm chấm để các nhóm đánh giá lẫn nhau. Kết luận, nhận định: - HS nhận xét, bổ sung, đánh giá phiếu học tập của một số nhóm đại diện (có thể bốc thăm hoặc theo chỉ định của GV). - GV nhận xét, đánh giá chung và rút ra kết luận. |
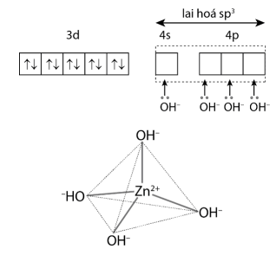
1. Trong ví dụ 1, mỗi phối tử Cl− hình thành 1 liên kết σ với nguyên tử trung tâm, nên dung lượng phối trí của nó bằng 1. Nguyên tử trung tâm liên kết với 4 phối tử Cl−, nên số phối trí của Co2+ trong phức chất này bằng 4. - Trong ví dụ 2, mỗi phối tử NH3 hình thành 1 liên kết σ với nguyên tử trung tâm, nên dung lượng phối trí của nó bằng 1. Nguyên tử trung tâm liên kết với 4 phối tử NH3, nên số phối trí của Zn2+ trong phức chất này bằng 4. - Liên kết trong phức chất tứ diện được hình thành do các phối tử cho bốn cặp electron chưa liên kết vào bốn orbital lai hoá sp3 trống của nguyên tử trung tâm. * Trong ion phức [Zn(OH)4]2– có 4 liên kết cho – nhận giữa 4 phối tử OH– với nguyên tử trung tâm Zn2+ (có cấu hình electron [Ar]3d10). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử OH– và 1 orbital lai hoá sp3 trống của ion Zn2+. |
|
Hoạt động 2: Mô tả sự hình thành liên kết trong phức chất bát diện Mục tiêu: - Biết được cách mô tả sự hình thành liên kết trong phức chất bát diện. - Thông qua việc hình thành kiến thức mới, HS phát triển được các năng lực chung và năng lực đặc thù. |
|
|
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|
Giao nhiệm vụ học tập: - GV yêu cầu các nhóm HS tìm hiểu thông tin trong SCĐ, làm việc nhóm để trả lời câu Thảo luận 2 trong SCĐ: 2. Hãy cho biết số phối trí của nguyên tử trung tâm và dung lượng phối trí của phối tử trong phức chất được nêu ở các ví dụ 3 và 4. - Kết quả câu trả lời của HS được trình bày trong Phiếu học tập số 2. Qua đó biết được cách mô tả sự hình thành liên kết trong phức chất bát diện theo thuyết Liên kết hoá trị. - GV yêu cầu HS làm việc theo cặp đôi thảo luận đưa ra trả lời cho câu Luyện tập trong SCĐ. * Mô tả sự hình thành liên kết trong ion phức [Cu(H2O)6]2+. - Câu trả lời của HS được trình bày trong Phiếu học tập số 2. Thực hiện nhiệm vụ: - HS chủ động suy nghĩ, xem thông tin trong SCĐ, độc lập đưa ra câu trả lời theo gợi ý của GV. - GV gợi ý, theo dõi và động viên, khích lệ HS đưa ra câu trả lời. Báo cáo, thảo luận: - GV lựa chọn HS đại diện của nhóm trình bày câu trả lời. - Các HS khác thảo luận về câu trả lời của bạn, bổ sung thêm các ý còn thiếu, đưa ra các câu hỏi còn băn khoăn để GV và các bạn trong lớp cùng giải đáp. Kết luận, nhận định: - HS nhận xét, bổ sung, đánh giá câu trả lời của bạn. - GV nhận xét, đánh giá chung và rút ra kết luận: |
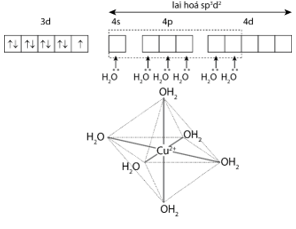
2. Trong ví dụ 3, dung lượng phối trí của NH3 bằng 1. Nguyên tử trung tâm liên kết với 6 phối tử NH3, nên số phối trí của Cr3+ trong phức chất này bằng 6. − Trong ví dụ 4, mỗi phối tử H2O hình thành 1 liên kết σ với nguyên tử trung tâm, nên dung lượng phối trí của nó bằng 1. Nguyên tử trung tâm liên kết với 6 phối tử H2O, nên số phối trí của Co3+ trong phức chất này bằng 6. – Liên kết trong phức chất bát diện được hình thành do các phối tử cho sáu cặp electron chưa liên kết vào sáu orbital lai hoá d2sp3 hoặc sp3d2 trống của nguyên tử trung tâm. * Trong ion phức [Cu(H2O)6]2+ có 6 liên kết cho – nhận giữa 6 phối tử H2O với nguyên tử trung tâm Cu2+ (có cấu hình electron [Ar]3d9). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử H2O và 1 orbital lai hoá sp3d2 trống của ion Cu2+. |
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Chuyên đề Hóa học 12 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm các bài soạn Giáo án Chuyên đề Hóa học lớp 12 Chân trời sáng tạo hay, chuẩn khác:
Giáo án Chuyên đề Hóa học 12 Bài 6: Một số khái niệm cơ bản về phức chất
Giáo án Chuyên đề Hóa học 12 Bài 8: Vai trò và ứng dụng của phức chất
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

