Giáo án Hóa học 8 Chương 3: Mol và tính toán hóa học mới nhất
Với mục đích giúp các Thầy / Cô giảng dạy môn Hóa học dễ dàng biên soạn Giáo án Hóa học lớp 8, VietJack biên soạn Bộ Giáo án Hóa học 8 Chương 3: Mol và tính toán hóa học phương pháp mới theo hướng phát triển năng lực bám sát mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu Giáo án Hóa học 8 này sẽ được Thầy/Cô đón nhận và đóng góp những ý kiến quí báu.
Mục lục Giáo án Hóa học 8 Chương 3: Mol và tính toán hóa học
- Giáo án Hóa học 8 Bài 18: Mol
- Giáo án Hóa học 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- Giáo án Hóa học 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất (Tiết 2)
- Giáo án Hóa học 8 Bài 20: Tỉ khối của chất khí
- Giáo án Hóa học 8 Bài 21: Tính theo công thức hóa học
- Giáo án Hóa học 8 Bài 21: Tính theo công thức hóa học (Tiết 2)
- Giáo án Hóa học 8 Bài 22: Tính theo phương trình hóa học
- Giáo án Hóa học 8 Bài 22: Tính theo phương trình hóa học (Tiết 2)
- Giáo án Hóa học 8 Bài 23: Bài luyện tập 4
Giáo án Hóa học 8 Bài 18: Mol
I.MỤC TIÊU:
1. Kiến thức :
Học sinh biết được định nghĩa: mol, khối lượng mol, thể tích mol chất khí ở điều kiện tiêu chuẩn (đktc: C, 1atm)
2. Kĩ năng :
Tính được khối lượng mol nguyên tử, mol phân tử của các chất theo công thức.
3. Thái độ :
Ham học hỏi và yêu thích bộ môn
4. Năng lực cần hướng tới :
-Năng lực sử dụng ngôn ngữ hóa học.
-Năng lực tính toán
-Năng lực sáng tạo
-Năng lực hợp tác
-Năng lực vận dụng kiến thức hóa học vào cuộc sống
II. TRỌNG TÂM:
Ý nghĩa của mol, khối lượng mol, thể tích mol.
III. CHUẨN BỊ:
- Bảng phụ đã ghi sẵn các bài tập (phiếu học tập)
- Phóng to hình 3.1
IV. TIẾN TRÌNH GIẢNG DẠY:
| GIÁO VIÊN | HỌC SINH | NỘI DUNG |
|---|---|---|
|
Hoạt động 1: Khởi động (5 phút) * Giới thiệu chương: Quan sát hình trang 62 SGK: ?Nhắc lại khái niệm “nguyên tử”, “phân tử”? Các em đã biết: Nguyên tử và phân tử là những hạt có kích thước và khối lượng vô cùng nhỏ nên không thể dùng những dụng cụ thông thường để cân hay đo. Tuy nhiên, trong hóa học chúng ta lại tìm hiểu về nguyên tử hoặc phân tử nên cần phải đếm được có bao nhiêu nguyên tử (phân tử), cân xem mỗi nguyên tử (phân tử) nặng bao nhiêu, thể tích bằng bao nhiêu? Vì vậy các nhà khoa học đề xuất một khái niệm dành cho những hạt vô cùng nhỏ này đó là Mol và cũng từ đó sẽ giúp chúng ta tính toán được những vấn đề đã nêu ở trên. Chương III: MOL VÀ TÍNH TOÁN HÓA HỌC Trước tiên chúng ta cùng làm quen với các khái niệm: Mol, khối lượng mol, thể tích mol của chất khí ở điều kiện tiêu chuẩn. Tiết 26: MOL |
||
Hoạt động 2: Hình thành kiến thức (25 phút) |
||
Hoạt động 2.1. Tìm hiểu khái niệm “Mol là gì?” |
||
|
-Giả sử HS A đi mua 1 chục cuốn vở. Vậy số lượng cuốn vở mà em sẽ mua là bao nhiêu? -Giả sử HS B đi 1 ram giấy in. Vậy số lượng giấy mà em sẽ mua là bao nhiêu tờ? GV: 10 và 500 là số lượng được qui định chục và ram. Vì vậy, định nghĩa mol cũng được dựa trên cơ sở đó GV: nêu định nghĩa mol GV: Số 6. 1023 : số Avôgađrô (N ) GV: gọi 1 HS đọc phần có thể em chưa biết Bài tập 1: ?1mol nguyên tử nhôm có chứa bao nhiêu nguyên tử nhôm ? ? 0,5 mol phân tử CO2 có chứa bao nhiêu phân tử CO2 ? -Treo bảng phụ có ghi sẵn bài tập -Hướng dẫn HS làm câu a. ? Mà con số 6.1023 còn được gọi là gì? Kí hiệu ntn? ?1mol nguyên tử nhôm có chứa còn có cách giải thích nào khác? ?Tương tự, 1 mol phân tử CO2 có chứa bao nhiêu phân tử CO2 ? *Lưu ý: Nếu đề bài hỏi về nguyên tử thì câu trả lời là nguyên từ, nếu hỏi về phân tử thì câu trả lời là phân tử. *Chuyển ý: Khối lượng của 1 chục cuốn vở và 1 ram giấy chính là khối lượng của 10 cuốn vở hoặc 500 tờ giấy in. Vậy khối lượng mol nguyên tử (phân tử) là gì ta cùng tìm hiểu phần II. |
-10 cuốn vở. -500 tờ. Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó - HS đọc - 6.1023 nguyên tử Al - 3.1023 phân tử CO2 -Chú ý cách làm -1 HS lên bảng, các HS còn lại làm vào giấy nháp. -Số Avogadro: N -1mol nguyên tử nhôm có chứa N nguyên tử nhôm. -1mol phân tử CO2 có chứa N phân tử CO2, |
I. Mol là gì? -Mol là lượng chất có chứa 6.1023 nguyên tử hoặc phân tử của chất đó - Số 6.1023 :số Avôgađrô (N ) Ví dụ: -1mol nguyên tử nhôm có chứa 6.1023 nguyên tử nhôm (N nguyên tử Al) -1mol phân tử CO2 có chứa 6.1023 phân tử CO2 (N phân tử CO2). |
Hoạt động 2.2. Hình thành khái niệm “khối lượng mol” |
||
|
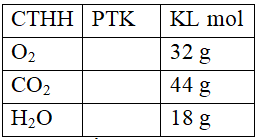
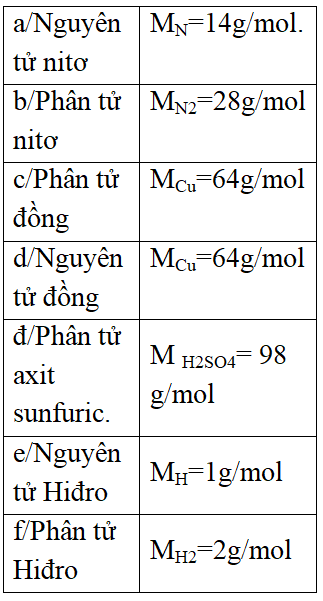
?Khối lượng kí hiệu là gì? ?Khối lượng có đơn vị là gì? -GV nêu định nghĩa khối lượng mol. ? Nhắc lại cách tính phân tử khối của 1 chất ? ? Tính PTK của các chất sau ?Nhận xét khối lượng mol với phận tử khối? *Lưu ý : +Khối lượng mol chính là phân tử khối của chất. +Cách biểu diễn: -Cu = 64, CO2 = 44 là phân tử khối -MCu = 64, MCO2 = 44 là khối lượng mol. Bài tập 2 : Tính khối lượng mol của: a/ Nguyên tử nitơ b/ Phân tử nitơ c/ Phân tử đồng d/ Nguyên tử đồng đ/ Phân tử axit sunfuric. e/ Nguyên tử Hiđro f/ Phân tử Hiđro. ?Em có nhận xét gì về khối lượng mol của nguyên tử nitơ và khối lượng mol của phân tử nitơ? ?Vì sao? ?Em có nhận xét gì về khối lượng mol của nguyên tử Cu và khối lượng mol của phân tử Cu? ?Vì sao? * Nitơ và Hiđro là hai chất khí. ?Nhận xét về khối lượng của 2 khí Vậy thể tích của chúng ntn chúng ta cùng sang phần III. |
-m -g -Khối lượng mol (M) của một chất là khối lượng tính bằng gam của N (6.1023) nguyên tử hoặc phân tử chất đó -Bằng tổng nguyên tử khối của các nguyên tử có trong phân tử chất. 32 đ.v.C 44 đ.v.C 18 đ.v.C - bằng nhau -Chú ý MN = 14 g/mol. MN2 = 28 g/mol MCu = 64 g/mol MCu = 64 g/mol M H2SO4 = 98 g/mol MH = 1g/mol MH2 = 2g/mol -Khác nhau -Vì Phân tử nitơ gồm 2 nguyên tử nitơ. -Bằng nhau -Vì Cu là kim loại nên phân tử chính là nguyên tử. -Khác nhau |
II. Khối lượng mol là gì? Khối lượng mol (M) của một chất là khối lượng tính bằng gam của N nguyên tử hoặc phân tử chất đó. Ví dụ : Tính khối lượng mol của: |
Hoạt động 2.3. Tìm hiểu thể tích mol của chất khí (10 phút) |
||
|
-Giới thiệu H3.1/64. Trong mỗi hộp đều chứa 1 mol khí khác nhau. ?1 mol mỗi khí đều chứa bao nhiêu phân tử khí? ?Nhận xét thể tích của 3 hộp? GV: Cung cấp định nghĩa. GV: ở nhiệt độ 0oC và áp suất 1 atm (ở đktc): thể tích của 1 mol bất kì chất khí nào cũng bằng 22,4 lít ? Viết thể tích mol của các chất khí H2, N2, CO2 ở đktc ? |
-Quan sát - Là thể tích chiếm bởi N phân tử của chất khí đó hoặc 6.1023 phân tử khí. -Bằng nhau - Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó - HS nghe và ghi vào vở VH2 = VN2 = VCO2 = 22,4 lít |
III.Thể tích mol của chất khí là gì? -Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của chất khí đó -Ở điều kiên tiêu chuẩn (t0 = 0oC, P = 1atm) 1 mol bất kì chất khí nào đều chiếm 1 thể tích bằng nhau và bằng 22,4 lít. |
Hoạt động 3: Củng cố, luyện tập (5 phút) |
||
|
-Hệ thống lại nội dung bài học +Mol là gì? Kí hiệu? đơn vị? +Khối lượng mol là gì? Kí hiệu? đơn vị? +Thể tích mol chất khí là gì? Kí hiệu? đơn vị? |
-Dựa vào nội dung đã học để trả lời và khắc sâu kiến thức | |
Hoạt động 4: Vận dụng (5 phút) |
||
|
Em hãy cho biết trong các câu nào sau đây đúng, sai A. Ở cùng điều kiện: thể tích của 0,5 mol khí N2 bằng thể tích của 0,5 mol khí SO2 B. Ở đktc: thể tích của 1mol khí CO là 56 lít C. Thể tích của 1mol khí H2 ở nhiệt độ phòng là 2 lít |
* Đáp án: A – Đ B – S C – S |
|
Hoạt động 5: Tìm tòi, mở rộng (5 phút) |
||
|
-Tìm hiểu 1 mol hạt gạo sẽ nuôi sống được loài người bao lâu? - Học bài giảng và chuẩn bài tiếp theo - BTVN: 1,2,3,4, sgk tr 65. |
||
V. RÚT KINH NGHIỆM:
Giáo án Hóa học 8 Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
I. MỤC TIÊU:
1. Kiến thức :
Học sinh biết được biểu thức biểu diễn mối liên hệ giữa lượng chất (n), khối lượng (m).
2. Kĩ năng :
Tính được m (hoặc n) khi biết các đại lượng có liên quan
3. Thái độ :
Hình thành tính cẩn thận trong tính toán.
4. Năng lực cần hướng tới :
-Năng lực sử dụng ngôn ngữ hóa học.
-Năng lực tính tóan hóa học
-Năng lực hợp tác
-Năng lực sáng tạo
II. TRỌNG TÂM:
Cách chuyển đổi giữa mol và khối lượng.
III. CHUẨN BỊ:
1. Giáo viên : Bảng phụ
2. Học sinh : Học bài và chuẩn bị bài trước khi đến lớp
IV. TIẾN TRÌNH BÀI GIẢNG:
| GIÁO VIÊN | HỌC SINH | NỘI DUNG GHI BẢNG |
|---|---|---|
|
Hoạt động 1: Khởi động (2 phút) Làm thế nào để tìm công thức tính khối lượng của các chất từ số mol và ngược lại. Để trả lời câu hỏi trên baì học hôm nay sẽ giúp cho các em hiểu vấn đề này. |
||
Hoạt động 2: Hình thành kiến thức (28 phút) |
||
Hoạt động 2.1. Tìm hiểu: “Cách chuyển đổi giữa lượng chất và khối lượng” |
||
|
? Vậy muốn tính khối lượng của một chất khi biết lượng chất (số mol) ta phải làm như thế nào? GV: Nếu ta đặt kí hiệu n là số mol chất hay lượng chất m là khối lượng M là khối lượng mol của chất ? Các em hãy thảo luận rút ra biểu thức tính khối lượng? GV: Ghi lại biểu thức trên bảng bằng phấn màu ? Gọi 1 HS giải thích kí hiệu của các đại lượng? ? Từ biểu thức trên em hãy nêu cách tính n (số mol)? (nếu biết m và M) ? Từ biểu thức trên em hãy nêu cách tính M? (nếu biết M và n) Chuyển ý: Vận dụng các công thức trên để giải một số bài tập |
- Muốn tính khối lượng: ta lấy khối lượng mol nhân với lượng chất (số mol) - HS thảo luận và trả lời m = n . M - n: là số mol - M: Khối lượng mol → n = → M = |
I. Chuyển đổi giữa lượng chất và khối lượng như thế nào? -Nhận xét: Nếu ta đặt kí hiệu +n: số mol chất (lượng chất) +m: khối lượng +M: khối lượng mol của chất -Ta có công thức chuyển đổi là: m = n . M → n = m/M (mol) , → M= m/n (g/mol) |
Hoạt động 2.2. Áp dụng làm bài tập vận dụng |
||
|
Bài tập 1 : Tính khối lượng của: a) 0,5 mol Al2O3 b) 0,75 mol MgO - Gọi 1 HS xác định các giá trị của đề bài cho? -Hướng dẫn HS tóm tắt đề bài ?Từ hai CTHH Al2O3 và MgO em biết được điều gì? ?Nêu cách giải? - GV thu vở của một số HS chấm điểm lấy điểm miệng. Bài tập 2 : Tính số mol của a) 20 g NaOH. b) 8 g CuO - Gọi 1 HS xác định các giá trị của đề bài cho? - Vận dụng công thức nào để tính số mol? - Gọi 1 HS nêu cách giải? Bài tập 3 : Tìm khối lượng mol của một hợp chất biết 0,125 mol chất này có khối lượng là 12,25g - Gọi 1 HS xác định các giá trị của đề bài cho? - Vận dụng công thức nào để tính n? - Gọi 1 HS nêu cách giải? Bài tập 4 : Tìm CTHH của đơn chất A biết 0,5 mol chất này có khối lượng là 28g. - Yêu cầu HS cả lớp làm vào vở nháp. - Gọi 4 HS lên bảng chữa 4 bài tập trên. - GV hướng dẫn HS phân tích đề bài toán: + Đại lượng đã biết ? + Đại lượng chưa biết ? + Ap dụng biểu thức nào để tính? +Thế dữ liệu vào CT → tính ra kết quả |
nAl2O3 = 0,5 mol nMgO = 0,75 mol - Tính được MAl2O3 = 102g/mol và MMgO = 40 g/mol → mAl2O3 = 0.5.102 = 5.1g → mMgO = 0.75 . 40 =30g - Tính MNaOH = 40 g/mol - Vận dụng: n = - HS làm vào vở bài tập - Xác định đại lượng đã cho. - Xác định công thức vận dụng để tính. - M = - HS đọc đề bài. - Xác định đại lượng đã cho và đại lượng cần tìm. - Vận dụng: M = - HS làm vào vở bài tập |
Bài tập vận dụng Bài tập 1 : Giải a) MAl2O3 = 27.2 + 16.3 = 102 (g/mol) m Al2O3 = n . M = 0,5. 102 = 5,1 g b) MMgO = 24 + 16 = 40 g/mol → mMgO = 0,75. 40 = 30 g Bài tập 2 : Tính số mol của a) MNaOH = 23 + 16 + 1 = 40 g/mol nNaOH = b) MCuO = 64 + 16 = 80 g/mol nCuO = Bài tập 3 : Giải M = Bài tập 4 : Khối lượng mol của đơn chất A là: MA = CTHH của A là : Sắt (Fe) |
Hoạt động 3: Củng cố, luyện tập (5 phút) |
||
|
Hệ thống lại nội dung bài học Nhắc lại công thức tính khối lượng, tính số mol, khối lượng mol? Nêu kí hiệu, đơn vị? |
Dựa vào nội dung bài học trả lời và khắc sâu kiến thức | |
Hoạt động 4: Vận dụng (5 phút) |
||
|
Tính khối lượng của N phân tử HCl? * Hướng dẫn: -N phân tử HCl tương ứng với mấy mol? -Đề bài yêu cầu tính đại lượng nào? -Có số mol → áp dụng công thức nào? |
N phân tử HCl = 1 mol HCl n = 1 mol mHCl = n.M =1.(1+35,5) =1.36,5 =36,5 g |
|
Hoạt động 5: Tìm tòi, mở rộng (5 phút) |
||
|
- Học bài giảng và xem lại khái niệm thể tích mol của chất khí và bài tập 3,4 trang 65 - Giải lại các bài tập trên để làm cơ sở để tìm hiểu mối liên hệ giữa lượng chất (số mol) với thể tích (V) |
||
V. RÚT KINH NGHIỆM:
Xem thêm các bài soạn Giáo án Hóa học lớp 8 theo hướng phát triển năng lực mới nhất, hay khác:
- Giáo án Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử
- Giáo án Hóa học 8 Chương 2: Phản ứng hóa học
- Giáo án Hóa học 8 Chương 4: Oxi - Không khí
- Giáo án Hóa học 8 Chương 5: Hiđro - Nước
- Giáo án Hóa học 8 Chương 6: Dung dịch
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giáo án Hóa học lớp 8 mới, chuẩn nhất của chúng tôi được biên soạn bám sát nội dung sgk Hóa học 8 theo chuẩn Giáo án của Bộ GD & ĐT.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 8 (các môn học)
- Giáo án điện tử lớp 8 (các môn học)
- Giáo án Toán 8
- Giáo án Ngữ văn 8
- Giáo án Tiếng Anh 8
- Giáo án Khoa học tự nhiên 8
- Giáo án KHTN 8
- Giáo án Lịch Sử 8
- Giáo án Địa Lí 8
- Giáo án GDCD 8
- Giáo án HĐTN 8
- Giáo án Tin học 8
- Giáo án Công nghệ 8
- Giáo án Vật Lí 8
- Giáo án Hóa học 8
- Giáo án Sinh học 8
- Đề thi lớp 8 (các môn học)
- Đề thi Ngữ Văn 8 (có đáp án)
- Chuyên đề Tiếng Việt lớp 8
- Đề thi Toán 8
- Đề cương ôn tập Toán 8
- Đề thi Tiếng Anh 8 (có đáp án)
- Đề thi Tiếng Anh 8 mới (có đáp án)
- Đề thi Khoa học tự nhiên 8 (có đáp án)
- Đề thi Lịch Sử và Địa Lí 8 (có đáp án)
- Đề thi GDCD 8 (có đáp án)
- Đề thi Tin học 8 (có đáp án)
- Đề thi Công nghệ 8 (có đáp án)

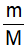
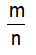
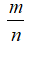
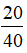 = 0,5 (mol)
= 0,5 (mol)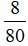 = 0,1 (mol)
= 0,1 (mol)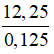 = 98 g/mol
= 98 g/mol 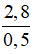 = 56 g
= 56 g


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

