H2S + Pb(NO3)2 → PbS + HNO3
Phản ứng H2S + Pb(NO3)2 tạo ra kết tủa PbS thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về SO2 có lời giải, mời các bạn đón xem:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
1. Phương trình hoá học của phản ứng H2S tác dụng với Pb(NO3)2
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
2. Điều kiện của phản ứng H2S tác dụng với Pb(NO3)2
- Phản ứng diễn ra ở ngay điều kiện thường.
3. Hiện tượng của phản ứng H2S tác dụng với Pb(NO3)2
- Dẫn khí H2S vào dung dịch muối Pb(NO3)2, hiện tượng quan sát được là có kết tủa màu đen (PbS) xuất hiện.
4. Phương trình ion thu gọn của phản ứng H2S tác dụng với Pb(NO3)2
Bước 1: Viết phương trình phân tử:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; Các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử ta được phương trình ion đầy đủ:
H2S + Pb2+ + 2NO3- → PbS↓ + 2H+ + 2NO3-
Bước 3: Lược bỏ đi các ion giống nhau ở 2 vế ta được phương trình ion rút gọn:
H2S + Pb2+ → PbS↓ + 2H+
5. Mở rộng kiến thức về H2S
5.1. Tính chất vật lí
- hydrogen sulfide là chất khí, rất độc, không màu, mùi trứng thối, hơi nặng hơn không khí ().
- hydrogen sulfide hóa lỏng ở -600C, tan ít trong nước, độ tan trong nước S = 0,38g/100g H2O (ở 200C, 1atm)
5.2. Tính chất hóa học
a. Tính axit yếu
- hydrogen sulfide tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn carbonic acid), có tên là hydrogen sulfide acid (H2S).
- hydrogen sulfide acid tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2− và muối axit như NaHS chứa ion HS−.Phương trình hóa học minh họa:
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
b. Tính khử mạnh
- H2S là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
- Khi tham gia phản ứng hóa học, tùy thuộc vào điều kiện phản ứng mà có thể bị oxi hóa thành
- H2S tác dụng với oxicó thể tạo S hoặc SO2 tùy lượng oxi và cách tiến hành phản ứng.
2H2S + 3O2 dư 2H2O + 2SO2
2H2S + O2 thiếu 2H2O + 2S
- Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
2H2S + 3O2 2H2O + 2SO2
5.3. Trạng thái tự nhiên. Điều chế
- Trong tự nhiên, H2S có trong một số nước muối, khí núi lửa và bốc ra từ xác chết của người và động vật …
- Trong công nghiệp không sản xuất H2S.
- Trong phòng thí nghiệm điều chế bằng cách cho dd HCl tác dụng với sắt(II) sunfua:
FeS + 2HCl → FeCl2 + H2S
6. Bài tập vận dụng liên quan
Câu 1: Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hóa - khử xảy ra
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. hydrogen sulfide acid mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn hydrogen sulfide acid
Hướng dẫn giải:
Đáp án B
H2S + CuSO4 → CuS↓ + H2SO4
Câu 2:Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng gì:
A. Chuyển thành màu nâu đỏ
B. Bị vẩn đục, màu vàng
C. Vẫn trong suốt không màu
D. Xuất hiện chất rắn màu đen.
Hướng dẫn giải:
Đáp án B
2H2S + O2 → 2S(↓ vàng) + 2H2O
Câu 3: Sục 2,24 lít khí H2S (đktc) vào dung dịch 0,2 mol Ba(OH)2 thì khối lượng muối tan thu được là:
A. 40,6 g
B. 33,8 g
C. 16,9 g
D. Kết quả khác
Hướng dẫn giải:
Đáp án C
→ Tỉ lệ : < 1 → tạo muối BaS
H2S + Ba(OH)2 → BaS + 2H2O
0,10,2→0,1
→ m BaS = 0,1 . 169 = 16,9 g
Câu 4:Cho sơ đồ của phản ứng:
H2S + KMnO4 + H2SO4 → H2O + S + MnSO4 + K2SO4
Hệ số cân bằng (là các số nguyên, tối giản) của các chất tham gia phản ứng là dãy số nào trong các dãy sau?
A. 3, 2, 5
B. 5, 2, 3
C. 2, 2, 5
D. 5, 2, 4
Hướng dẫn giải:
Đáp án B
5H2S + 2KMnO4+ 3H2SO4 → 8H2O + 5S + 2MnSO4+ K2SO4
Câu 5: Cho sơ đồ phản ứng hóa học: H2S + O2 (dư) X + H2O. Chất X có thể là
A. SO2
B. S
C. SO3
D. S hoặc SO2
Hướng dẫn giải:
Đáp án A
Do O2 dư nên X là SO2, phương trình hóa học:
H2S + 3O2 (dư) 2SO2 + 2H2O
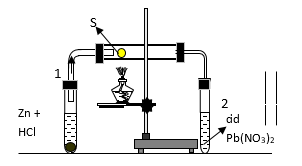
Câu 6: Cho thí nghiệm được lắp như như hình vẽ sau:
Ống nghiệm 1 đựng HCl và Zn, ống nghiệm nằm ngang chứa bột S, ống nghiệm 2 chứa dung dịch Pb(NO3)2 . Phản ứng xảy ra trong ống nghiệm nằm ngang là:
A. Zn + 2HCl → ZnCl2 + H2
B. H2 + S H2S
C. H2S + Pb(NO3)2 → PbS↓ + 2HNO3
D. 2HCl + Pb(NO3)2 → PbCl2↓ + 2HNO3
Hướng dẫn giải:
Đáp án B
- Ống nghiệm (1): Zn phản ứng với HCl sinh ra khí H2
Zn + 2HCl → ZnCl2 + H2
- Ống nghiệm nằm ngang: H2 bay ra gặp S (đun nóng) thì có phản ứng:
H2 + S H2S
- Ống nghiệm (2): Khí H2S bay ra khỏi ống nghiệm nằm ngang phản ứng với dung dịch Pb(NO3)2 tạo kết tủa màu đen
H2S + Pb(NO3)2 → PbS ↓ + 2HNO3
Câu 7:Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D = 1,28). Nồng độ % muối trong dung dịch là
A. 47, 92%
B. 42, 96%
C. 42,69%
D. 24,97%
Hướng dẫn giải:
Đáp án B
; nNaOH = = 0,4 mol
2H2S + 3O2 → 2SO2+ 2H2O
Ta thấy: Tạo muối axit: NaOH + SO2 →NaHSO3
Theo PTHH:
→ mdd sau= 50.1,28 + 0,4.64 + 0,4.18 = 96,8g
→
Câu 8:Cho sản phẩm khí thu được khi đốt cháy 17,92 lít khí H2S (đktc) sục vào 200 ml dung dịch NaOH 25% (d = 1,28g/ml). Tính nồng độ phần trăm muối trong dung dịch ?
A. 32,81%
B. 23,81%
C. 18,23%
D. 18,32%
Hướng dẫn giải:
Đáp án A
BTNT “S”:
m dd NaOH = 200.1,28 = 256 gam
→ mNaOH = 256.25% = 64 gam
→ nNaOH = 1,6 mol
→ Muối sinh ra là Na2SO3
2NaOH + SO2 → Na2SO3 + H2O
Theo PTHH:
Khối lượng dung dịch sau phản ứng :
m dd sau pư = 256 + 0,8.64 = 307,2 gam
Vậy
Câu 9:Nung hỗn hợp X gồm m gam Fe và a gam S ở nhiệt độ cao, sau một thời gian thu được chất rắn Y. Cho Y vào dung dịch HCl dư thu được 2,688 lít hỗn hợp khí Z và còn lại một chất rắn không tan. Giá trị của m là
A. 11,20
B. 6,72
C. 5,60
D. 22,40
Hướng dẫngiải
Đáp án B
Ta có: nZ = 0,12 mol
Bảo toàn nguyên tố H:
→ nHCl = 0,24 mol
Bảo toàn nguyên tố Cl:
Bảo toàn nguyên tố Fe:
→mFe = 6,72g
Câu 10: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Gía trị của m là:
A. 33,6 gam
B. 38,4 gam
C. 3,36 gam
D. 3,84 gam
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng:
H2S + CuSO4 →CuS↓ + H2SO4.
Ta có:
⇒ H2S dư và CuSO4 hết.
Xem thêm các phương trình hóa học hay khác:
- H2S + CuSO4 → CuS↓ + H2SO4
- H2S + H2SO4 đậm đặc → SO2↑+ 2H2O + S↓
- 2H2S + 3O2 2SO2↑ + 2H2O
- H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
- S + O2 SO2
- H2S + 2NaOH → Na2S + 2H2O
- S + 6HNO3 → H2SO4 + 6NO2↑+ 2H2O
- H2S + NaOH → NaHS + H2O
- S + 2H2SO4 đặc 3SO2↑+ 2H2O
- 3H2S + 2HNO3 → 4H2O + 2NO↑ + 3S↓
- S + H2 H2S
- SO2 + Na2O Na2SO3
- SO2 + 2KOH → K2SO3 + H2O
- SO2 + H2S → 3S↓ + 2H2O
- 2SO2 + 2NaH → H2S↑ + Na2SO4
- SO2 + Br2 + 2H2O →H2SO4 + 2HBr
- SO2 + Cl2 + 2H2O → 2HCl + H2SO4
- 2SO2 + O2 2SO3
- 2SO2 + O2 + 2H2O → 2H2SO4
- 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
- SO3 + H2O → H2SO4
- H2S + 2FeCl3 → S↓ + 2FeCl2 + 2HCl
- 3H2S + 2KMnO4 → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
- H2S + 4Br2 + 4H2O → 8HBr + H2SO4
- H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



