KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O | KMnO4 + HCl ra Cl2
Phản ứng KMnO4 + HCl tạo ra khí Cl2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Mn có lời giải, mời các bạn đón xem:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
1. Phương trình hóa học của phản ứng KMnO4 tác dụng với HCl
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phản ứng này được ứng dụng để điều chế Cl2 trong phòng thí nghiệm.
2. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa – khử:
Chất khử: HCl; chất oxi hóa: KMnO4
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
- Quá trình oxi hóa:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa
Bước 4: Điền hệ số của các chất có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3. Điều kiện để KMnO4 tác dụng với HCl
HCl đặc, điều kiện thường.
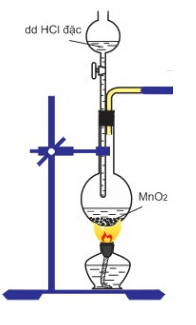
4. Cách tiến hành thí nghiệm
- Cho vào ống nghiệm khô một vài tinh thể KMnO4, nhỏ tiếp vào ống vài giọt dung dịch HCl đậm đặc. Đậy kín ống nghiệm bằng nút bông tẩm dung dịch NaOH.
5. Hiện tượng phản ứng
Có khí màu vàng lục thoát ra, chính là Cl2. Vì khí Cl2 thoát ra gây độc chính vì vậy khi làm xong thí nghiệm cần thêm lượng dư dung dịch kiềm để trung hòa lượng HCl dư và tác dụng hết với Cl2 trong bình trước khi đổ ra môi trường.
6. Mở rộng kiến thức về HCl
6.1. Tính chất vật lí
- Hiđro clorua tan vào nước tạo thành dung dịch hydrochloric acid.
- hydrochloric acid là chất lỏng, không màu, mùi xốc.
- Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
- Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
6.2. Tính chất hóa học
Hydrochloric acid là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại. Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với basic oxide và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
6.3. Điều chế
a) Trong phòng thí nghiệm
- Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được hydrochloric acid.
- Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc NaHSO4 + HCl ↑
b) Trong công nghiệp
- Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
H2 + Cl2 2HCl
anhh
- Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
7. Bài tập vận dụng liên quan
Câu 1:Cho m gam KMnO4 tác dụng với dung dịch HCl đặc dư thu được dung dịch X chứa HCl dư và 28,07 gam hai muối và V lít khí Cl2 (đktc). Lượng khí Cl2 sinh ra oxi hóa vừa đủ 7,5 gam hỗn hợp gồm Al và kim loại M có có tỉ lệ mol Al : M = 1: 2. Kim loại M là
A. Ca
B. Mg
C. Fe
D. Cu
Hướng dẫn giải:
Đáp án B
16 HCl + 2 KMnO4 → 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2
Theo PTHH:
Khối lượng muối là 28,07
→ x.74,5 + x.126 = 28,07
→ x = 0,14 mol
Theo PTHH
Theo định luật bảo toàn e:
n M . x + n Al. 3 = . 2 = 0,7 mol
Có tỉ lệ mol Al: M = 1: 2 → n Al = a thì n M = 2 a
→ 2a. x + a. 3 = 0,7 mol
→ Với x = 1 → a = 0,175 mol → m Al = 0,175. 27 = 4,725 g
→ m M = 7,5 – 4,725 = 2,775 g
(loại)
→ Với x = 2 → a = 0,1 mol → m Al = 27. 0,1 = 2,7 g → m M = 7,5 – 2,7 = 4,8 g
(Mg , chọn)
Vậy kim loại cần tìm là Mg
Câu 2: Cho chuỗi phản ứng:
KMnO4 + (A) → X2 ↑+ (B) + (C) + H2O
(C) + H2O X2 ↑ + (D) + (I)
X2 + (D) → (A)
X2 + (I) → (C) + (E) + H2O
Các chất A, X2, C, D, E lần lượt là:
A. HF, F2, KF, H2, KFO.
B. HCl, Cl2, MnCl2, H2, KCl
C. HCl, Cl2, KCl, H2, KClO
D. HBr, Br2, KBr, H2, KBrO
Hướng dẫn giải:
Đáp án C
2KMnO4 + 16HClđặc (A) → 5Cl2(X2) + 2MnCl2 (B) +2KCl (C) + 8H2O
2KCl + 2H2O Cl2 + 2KOH(I) + H2(D)
Cl2 + H2 2HCl
Cl2 + 2KOH → KCl + KClO (E) + H2O
Câu 3: Cho 8,7 gam MnO2 tác dụng với dung dịch HCl đậm đặc sinh ra V lít khí Cl2 (ở đktc). Hiệu suất phản ứng là 85%. V có giá trị là
A. 2 lít
B. 1,904 lít
C. 1,82 lít
D. 2,905 lít
Hướng dẫn giải:
Đáp án B
Phương trình hóa học:
MnO2 + 4HCl MCl2 + Cl2 + 2H2O
Theo PTHH: (số mol lý thuyết tính theo PTHH)
→ → n clo thực tế = 0,085 mol
lít
Câu 4: Điều chế Cl2 từ HCl và MnO2. Cho toàn bộ khí Cl2 điều chế được qua dung dịch NaI, sau phản ứng thấy có 12,7 gam I2 sinh ra. Khối lượng HCl có trong dung dịch đã dùng là:
A. 9,1 gam
B. 8,3 gam
C. 7,3 gam
D. 12,5 gam
Hướng dẫn giải:
Đáp án C
Theo PTHH: Cl2 + 2 NaI → 2 NaCl + I2
Theo PTHH: MnO2 + 4HCl MnCl2 + 2H2O +Cl2
= 0,05.4 = 0,2 mol
→ m HCl = 0,2. 36,5 = 7,3 g
Câu 5:Hiện tượng xảy ra trong thí nghiệm là:
A. Chỉ có khí màu vàng thoát ra
B. Có khí màu vàng sinh ra, đồng thời có kết tủa
C. Chất rắn MnO2 tan dần
D. Có khí màu vàng sinh ra, đồng thời MnO2 tan dần
Hướng dẫn giải:
Đáp án D
Phản ứng: MnO2 + 4HClđ MnCl2 + Cl2↑ + 2H2O
→ Hiện tượng của phản ứng: Có khí màu vàng thoát ra, MnO2 tan dần.
Câu 6. Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là
A. 0,3. B. 0,4. C. 0,2. D. 0,1.
Hướng dẫn giải:
Đáp án C
nHCl = 0,1.0,02 = 0,002 mol
HCl + NaOH → NaCl + H2O
0,002 → 0,002 mol
Câu 7: Cho 36 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00. B. 0,50. C. 0,75. D. 1,25.
Hướng dẫn giải:
Đáp án A
2HCl + FeO → FeCl2 + H2O
Theo PTHH: nHCl = 2nFeO = 1 mol
Câu 8. Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Hướng dẫn giải:
Đáp án B
6HCl + Al2O3 → 2AlCl3 + 3H2O
0,3 → 0,05 mol
= 0,05.102 = 5,1 gam
Câu 9. Cho 5,6 gam một oxit kim loại tác dụng vừa đủ với HCl cho 11,1 gam muối clorua của kim loại đó. Cho biết công thức oxit kim loại?
A. Al2O3. B. CaO. C. CuO. D. FeO.
Hướng dẫn giải:
Đáp án B
Gọi công thức oxit là M2Oa
2aHCl + M2Oa → 2MCla + aH2O
Gọi số mol H2O là x (mol) ⇒ nHCl = 2x (mol)
Bảo toàn khối lượng: 36,5.2x + 5,6 = 11,1 + 18.x
⇒ x = 0,1 mol
a |
1 |
2 |
3 |
M |
20 |
40 |
60 |
Kết luận |
Loại |
Ca |
Loại |
Câu 10. Cho 30,00 gam hỗn hợp X gồm Fe và FeO phản ứng với dung dịch HCl dư, đến khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc). Khối lượng của FeO trong 30,00 gam hỗn hợp X là
A. 13,2 gam. B. 46,8 gam. C. 16,8 gam. D. 5,6 gam.
Hướng dẫn giải:
Đáp án A
2HCl + FeO → FeCl2 + H2O
2HCl + Fe → FeCl2 + H2
Theo PTHH:
nFe = nkhí = 0,3 mol ⇒ mFeO = 30 – 0,3.56 = 13,2 gam.
Câu 11. Để hoà tan hết hỗn hợp Zn và ZnO phải dùng 100,8 ml dung dịch HCl 36,5% (D = 1,19g/ml) thu được 0,4 mol khí. Phần trăm về khối lượng hỗn hợp Zn và ZnO ban đầu lần lượt là
A. 40% và 60%.. B. 45% và 55%.
C. 50% và 50% D. 61,6% và 38,4%.
Hướng dẫn giải:
Đáp án D
2HCl + ZnO → ZnCl2 + H2O (1)
2HCl + Zn → ZnCl2 + H2 (2)
Theo PTHH (2):
nHCl (2) = 2.nZn = 0,8 mol ⇒ nHCl (1) = 1,2 – 0,8 = 0,4 mol
mhỗn hợp = 0,4.65 + 0,2.81 = 42,2 gam
Câu 12. Cho 36,5 gam dung dịch HCl 10% vào một cốc đựng NaHCO3 dư thì thu được V lit khí ở đktc. Giá trị của x là
A. 44,8. B. 4,48. C. 22,4. D. 2,24.
Hướng dẫn giải:
Đáp án D
NaHCO3 + HCl → NaCl + H2O + CO2
0,1 0,1 mol
⇒ V = 0,1.22,4 = 2,24 lít.
Câu 13. Cho 50 gam CaCO3 tác dụng vừa đủ với dung dịch HCl 20% (D =1,2g/ml). Khối lượng dung dịch HCl đã dùng là
A. 152,08 gam. B. 55,0 gam.
C. 180,0 gam. D. 182,5 gam.
Hướng dẫn giải:
Đáp án D
CaCO3 + 2HCl → CaCl2 + H2O + CO2
0,5 → 1 mol
Xem thêm các phương trình hóa học hay khác:
- Mn + O2 → MnO2
- 2Mn + O2 → 2MnO
- Mn + Cl2 → MnCl2
- Mn + I2 → MnI2
- Mn + Br2 → MnBr2
- Mn + S → MnS
- 3Mn + N2 → Mn3N2
- Mn + F2 → MnF2
- 3Mn + 2AlCl3 → MnCl2 + 2Al
- Mn + 2HCl → MnCl2 + H2
- Mn + H2SO4(loãng) → MnSO4 + H2
- Mn(bột) + 2H2O → Mn(OH)2 + H2 ↑
- Mn + 2H2SO4(đặc) → MnSO4 + 2H2O + SO2
- 3Mn + 8HNO3 → 3Mn(NO3)2 + 4H2O + 2NO
- Mn + 4HNO3 → Mn(NO3)2 + 2NO2 + 2H2O
- 5Mn + 12HNO3 → 5Mn(NO3)2 + N2 + 6H2O
- 4Mn + 10HNO3 → 4Mn(NO3)2 + N2O + 5H2O
- 4Mn + 10HNO3 → 4Mn(NO3)2 + NH4NO3 + 3H2O
- Mn + 2H3PO4 → Mn3(PO4)2 + 3H2
- Mn + H2S → MnS + H2
- 2KMnO4 + 3H2S → 2KOH + 2MnO2↓ + 3S↓ + 2H2O
- 2KMnO4 K2MnO4 + MnO2 + O2↑
- MnO2 + 4HCl đặc MnCl2 + Cl2↑ + 2H2O
- 2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



