Năng lượng hóa học (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Chuyên đề Năng lượng hóa học có trong bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 đầy đủ lý thuyết và bài tập đa dạng có lời giải giúp học sinh có thêm tài liệu ôn tập cho bài thi tốt nghiệp THPT môn Hóa học.
Năng lượng hóa học (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Chỉ từ 350k mua trọn bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
I. LÝ THUYẾT TRỌNG TÂM
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
- Phản ứng thu nhiệt là phản ứng hấp thu năng lượng dưới dạng nhiệt.
- Biến thiên enthalpy của phản ứng là nhiệt lượng toả ra hay thu vào của phản ứng ở một điều kiện xác định.
- Biểu thức tính biến thiên enthalpy của các phản ứng ở điều kiện chuẩn:
+ Theo nhiệt tạo thành:
+ Theo năng lượng liên kết (các chất đều ở thể khí):
- Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
: phản ứng thu nhiệt
: phản ứng tỏa nhiệt
⇒ Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
II. CÂU HỎI ÔN LUYỆN
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Câu 1. Cho phương trình nhiệt hóa học của phản ứng:
Lượng nhiệt cần cung cấp để tạo thành 56 g CO(g) là
A. 140 kJ.
B. 560 kJ.
C. –140 kJ.
D. –560 kJ.
Câu 2. Phản ứng nào sau đây là phản ứng toả nhiệt?
A. Phản ứng nhiệt phân muối KNO3.
B. Phản ứng phân huỷ khí NH3.
C. Phản ứng oxi hoá glucose trong cơ thể.
D. Phản ứng hoà tan NH4Cl trong nước.
Câu 3. Cho hai phương trình nhiệt hóa học sau:
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
A. Phản ứng (1) tỏa nhiệt và phản ứng (2) thu nhiệt.
B. Cả 2 phản ứng đều tỏa nhiệt.
C. Cả 2 phản ứng đều thu nhiệt.
D. Phản ứng (1) thu nhiệt và phản ứng (2) tỏa nhiệt.
Câu 4. Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C (than chì) + .
B. C (than chì) + .
C. C (than chì) + .
D. C (than chì) + .
Câu 5. Cho enthalpy tạo thành chuẩn của một số chất như sau:
|
Chất |
TiCl4(g) |
H2O(l) |
TiO2(s) |
HCl(g) |
|
(kJ/mol) |
-763 |
-286 |
-945 |
-92 |
Biến thiên enthalpy chuẩn của phản ứng là
A. +3 kJ.
B. +22 kJ.
C. −22 kJ.
D. −3229 kJ.
Câu 6. Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình:
Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ 25°C đến 50°C. Kết luận nào sau đây là đúng?
A. Phản ứng trên là phản ứng thu nhiệt.
B. Phản ứng trên có giá trị ∆H > 0.
C. Phản ứng có năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
D. Phản ứng trên giải phóng năng lượng dưới dạng nhiệt.
Câu 7. Cho các phương trình nhiệt hóa học:
Trong các phản ứng trên, phản ứng tỏa nhiệt là
A. (1), (3).
B. (2), (3).
C. (2).
D. (1).
Câu 8. Công thức tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết là
Câu 9. Phát biểu nào sau đây đúng về điều kiện chuẩn?
A. Là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K.
B. Là điều kiện ứng với nhiệt độ 298K và áp suất 1 atm.
C. Là điều kiện ứng với 760 mmHg.
D. Là điều kiện ứng với áp suất 1 atm và nhiệt độ 0oC (273K).
Câu 10. Năng lượng liên kết Cl – Cl là 243 kJ mol-1, của H – H là 436 kJ mol-1. Cho biết enthalpy tạo thành chuẩn của HCl là − 91 kJ mol-1. Năng lượng liên kết của H – Cl là
A. 430,5 kJ mol-1.
B. 290,0 kJ mol-1.
C. 490,0 kJ mol-1.
D. 245,0 kJ mol-1.
Câu 11. Cho phản ứng:
Phát biểu nào dưới đây là không đúng?
A. Biến thiên enthalpy chuẩn của phản ứng là 57,9 kJ.
B. Nhiệt tạo thành chuẩn của NaCl(aq) là -57,9 kJ mol-1.
C. Phản ứng là phản ứng tỏa nhiệt.
D. Phản ứng làm nóng môi trường xung quanh.
Câu 12. Enthalpy tạo thành chuẩn của một chất () là lượng nhiệt kèm theo của phản ứng tạo thành:
A. 1 gam chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
B. 1 gam chất đó từ các đơn chất ở dạng bền nhất trong điều kiện tiêu chuẩn.
C. 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
D. 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện tiêu chuẩn.
Câu 13. Enthalpy tạo thành chuẩn của các khí O3, CO2, NH3 và HI lần lượt là 142,2 kJ mol-1; -393,3 kJ mol-1; −45,9 kJ mol-1 và 26,5 kJ mol-1. Dãy có độ bền tăng dần của các hợp chất trên là
A. NH3, HI, CO2, O3.
B. O3, HI, NH3, CO2.
C. O3, CO2, NH3, HI.
D. CO2, NH3, HI, O3.
Câu 14. Enthalpy tạo thành chuẩn (nhiệt tạo thành ở điều kiện chuẩn) có kí hiệu là
A. .
B. .
C. ∆S.
D. ∆T.
Câu 15. Khí thiên nhiên chứa chủ yếu các thành phần chính: methane (CH4), ethane (C2H6) và một số thành phần khác. Cho các phương trình nhiệt hóa học sau:
Giả sử, một hộ gia đình cần 10 000kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ dùng hết bình gas 13 kg khí thiên nhiên với tỉ lệ thể tích của methane : ethane là 85 : 15 (thành phần khác không đáng kể) với hiệu suất hấp thụ nhiệt khoảng 65%)
A. 46 ngày.
B. 43 ngày.
C. 53 ngày.
D. 55 ngày.
Câu 16. Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C–H |
C–C |
C=C |
|
Eb (kJ mol – 1 ) |
418 |
346 |
612 |
Biến thiên enthalpy chuẩn của phản ứng: có giá trị là
A. +103 kJ.
B. –103 kJ.
C. +80 kJ.
D. –80 kJ.
Câu 17. Biết rằng ở điều kiện chuẩn, 1 mol ethanol cháy tỏa ra một nhiệt lượng là 1,37.103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng lượng được giải phóng ra dưới dạng nhiệt bởi phản ứng là
A. 0,450 kJ.
B. 2,25.103 kJ.
C. 4,5.102 kJ.
D. 1,37.103kJ.
Câu 18. Dung dịch glucose (C6H12O6) 5%, có khối lượng riêng là 1,02 g/mL, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai nước chứa 500 mL dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
A. +397,09 kJ.
B. -397,09 kJ.
C. +416,02 kJ.
D. -416,02 kJ.
................................
................................
................................
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Xem thêm các chuyên đề ôn thi tốt nghiệp THPT môn Hóa học năm 2026 có đáp án hay khác:
Chuyên đề: Hợp chất carbonyl - carboxylic acid (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Cấu tạo nguyên nguyên tử (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Bảng tuần hoàn các nguyên tố hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Liên kết hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Phản ứng oxi hóa - khử (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Nguyên tố nhóm VIIA (Nhóm Halogen) (Ôn thi Hóa học Tốt nghiệp 2026)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều


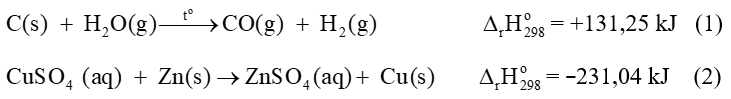
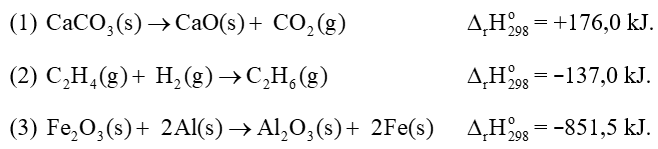
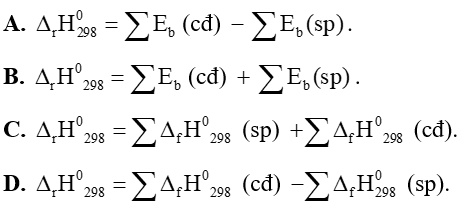
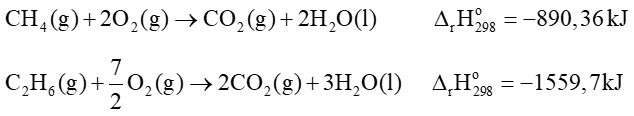



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

