Tốc độ phản ứng (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Chuyên đề Tốc độ phản ứng có trong bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 đầy đủ lý thuyết và bài tập đa dạng có lời giải giúp học sinh có thêm tài liệu ôn tập cho bài thi tốt nghiệp THPT môn Hóa học.
Tốc độ phản ứng (Chuyên đề Hóa học ôn thi Tốt nghiệp 2026)
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Chỉ từ 350k mua trọn bộ Chuyên đề ôn thi Tốt nghiệp Hóa học năm 2026 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
I. LÝ THUYẾT TRỌNG TÂM
1. Tốc độ phản ứng hóa học
- Tốc độ phản ứng đặc trưng cho sự nhanh, chậm của một phản ứng hoá học.
- Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), … Lượng chất có thể được biểu diễn bằng số mol, nồng độ mol, khối lượng hoặc thể tích.
- Xét phản ứng tổng quát: aA + bB → cC + dD
Tốc độ trung bình của phản ứng là: =
Với lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian ∆t.
2. Định luật tác dụng khối lượng
- Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
- Với phản ứng đơn giản: aA + bB → sản phẩm. Tốc độ phản ứng được tính:
3. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng gồm nồng độ chất tan, áp suất (đối với chất khí), nhiệt độ, diện tích bề mặt tiếp xúc, chất xúc tác.
- Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
- Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
- Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.
- Để tăng tốc độ phản ứng ta có thể tăng diện tích bề mặt tiếp xúc của chất phản ứng bằng cách làm giảm kích thước hạt rắn hoặc tạo những hạt xốp.
- Chất xúc tác làm tăng tốc độ phản ứng nhưng không bị biến đổi về lượng và chất sau phản ứng.
* Hệ số nhiệt Van’t Hoff
Với đa số các phản ứng, khi nhiệt độ tăng 10oC thì tốc độ độ phản ứng tăng từ 2 đến 4 lần. Giá trị này được gọi là hệ số nhiệt độ Van’t Hoff, có liên hệ với tốc độ phản ứng và nhiệt độ qua biểu thức:
II. CÂU HỎI ÔN LUYỆN
Phần 1. Trắc nghiệm nhiều phương án lựa chọn
Câu 1. Cho phản ứng hóa học sau: Zn (s) + H2SO4 (aq, dư) → ZnSO4 (aq) + H2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt Zn.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
Câu 2. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ của phản ứng rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ.
B. Nồng độ.
C. Chất xúc tác.
D. Áp suất.
Câu 3. Trong các cặp phản ứng sau, nếu lượng Fe trong các cặp đều được lấy bằng nhau và có kích thước như nhau thì cặp nào có tốc độ phản ứng lớn nhất?
A. Fe + dung dịch HCl 0,1 M.
B. Fe + dung dịch HCl 0,2 M.
C. Fe + dung dịch HCl 0,3 M.
D. Fe + dung dịch HCl 0,5 M.
Câu 4. Cho phương trình hóa học của phản ứng tổng hợp ammonia như sau:
Khi tăng nồng độ của hydrogen lên 2 lần, tốc độ phản ứng thuận
A. tăng lên 8 lần.
B. giảm đi 2 lần.
C. tăng lên 6 lần.
D. tăng lên 2 lần.
Câu 5. Đối với phản ứng: A + 3B ⟶ 2C, phát biểu nào sau đây đúng?
A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C.
B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C.
C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C.
D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C.
Câu 6. Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t1 < t2 < t3.
B. t1 = t2 = t3.
C. t3 < t2 < t1.
D. t2 < t1 < t3.
Câu 7. Xét phản ứng: A + 2B → 3C + D. Tốc độ trung bình của sự mất đi của B tương đương với biểu thức nào sau đây?
A. .
B. .
C. .
D. .
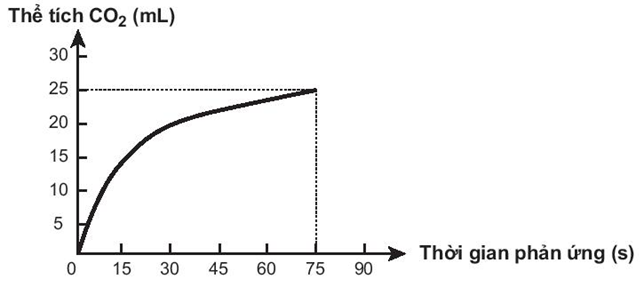
Câu 8. Thực hiện phản ứng sau:
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
Trong các phát biểu sau, phát biểu nào không đúng?
A. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
B. Tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
Câu 9. Cho phản ứng đơn giản: H2 + I2 → 2HI
Người ta thực hiện 3 thí nghiệm với nồng độ các chất đầu ( và ) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
|
(M) |
(M) |
|
|
0,10 |
0,20 |
5,00 |
|
0,20 |
0,20 |
10,00 |
|
0,10 |
0,15 |
3,75 |
Biểu thức định luật tác dụng viết cho phản ứng trên là
A. .
B. .
C. .
D. .
Câu 10. Cho phản ứng điều chế khí oxygen trong phòng thí nghiệm bằng cách nhiệt phân muối potassium chlorate (KClO3):
Trong các biện pháp sau:
(a) Dùng chất xúc tác manganese dioxide (MnO2).
(b) Dùng phương pháp dời nước để thu khí oxygen.
(c) Nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao.
Những biện pháp được sử dụng để làm tăng tốc độ phản ứng là
A. a, c.
B. a, b.
C. b, c.
D. a, b, c.
Câu 11. Tốc độ phản ứng là
A. độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
Câu 12. Phát biểu nào sau đây là đúng?
A. Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương.
B. Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
C. Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
D. Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
Câu 13. Tốc độ trung bình của một phản ứng được viết theo biến thiên nồng độ các chất theo thời gian như sau:
Phản ứng đó là
A. 4A + B → 2C + 3D.
B. 4A + 2B → 2C + 3D.
C. .
D. B + 4D → 2C + 3A.
Câu 14. Cho phản ứng sau:
Sau một thời gian đo được: .
Tốc độ trung bình của phản ứng trên trong khoảng thời gian đó là
A. .
B. .
C. .
D. .
Câu 15. Cho phản ứng X + Y → Z. Khi bắt đầu phản ứng, nồng độ chất X là 0,024 mol/L. Sau 10s xảy ra phản ứng, nồng độ của X là 0,022 mol/L. Tốc độ phản ứng trong trường hợp này là
A. 0,0003 mol/L.s.
B. 0,00025 mol/L.s.
C. 0,00015 mol/L.s.
D. 0,0002 mol/L.s.
Câu 16. NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp HNO3 và HCl có tỉ lệ 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau: 2NOCl → 2NO + Cl2. Tốc độ phản ứng ở 70°C là 2.10-7 mol/(L.s) và ở 80°C là 4,5.10-7 mol/(L.s). Hệ số nhiệt độ của phản ứng là
A. 2,25.
B. 2,5.
C. 3.
D. 1,75.
Câu 17. Khi nhiệt độ tăng lên 10 oC, tốc độ của một phản ứng hóa học tăng lên 3 lần. Hỏi tốc độ của phản ứng đó tăng lên bao nhiêu lần khi nâng nhiệt độ lên từ 30 oC đến 50 oC?
A. 3 lần.
B. 6 lần.
C. 9 lần.
D. 27 lần.
Câu 18. Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất Y trong khoảng thời gian trên là
A. 4,0.10−4 mol/(L.s).
B. 1,0.10−4 mol/(L.s).
C. 2.10−4 mol/(L.s).
D. 0,5.10−4 mol/(L.s).
................................
................................
................................
Xem thử Đề thi Tốt nghiệp Hóa 2025 Xem thử Đề thi thử Tốt nghiệp Hóa 2025 Xem thử Chuyên đề ôn thi Tốt nghiệp Hóa Xem thử 1000 câu trắc nghiệm Hóa
Xem thêm các chuyên đề ôn thi tốt nghiệp THPT môn Hóa học năm 2026 có đáp án hay khác:
Chuyên đề: Hợp chất carbonyl - carboxylic acid (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Cấu tạo nguyên nguyên tử (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Bảng tuần hoàn các nguyên tố hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Liên kết hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Phản ứng oxi hóa - khử (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Năng lượng hóa học (Ôn thi Hóa học Tốt nghiệp 2026)
Chuyên đề: Nguyên tố nhóm VIIA (Nhóm Halogen) (Ôn thi Hóa học Tốt nghiệp 2026)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

