3 Đề thi Giữa kì 2 Hóa học 12 Cánh diều (cấu trúc mới, có đáp án)
Với bộ 3 Đề thi Giữa kì 2 Hóa học 12 Cánh diều năm 2026 theo cấu trúc mới có đáp án và ma trận được biên soạn và chọn lọc từ đề thi Hóa học 12 của các trường THPT trên cả nước sẽ giúp học sinh lớp 12 ôn tập và đạt kết quả cao trong các bài thi Giữa kì 2 Hóa 12.
3 Đề thi Giữa kì 2 Hóa học 12 Cánh diều (cấu trúc mới, có đáp án)
Chỉ từ 70k mua trọn bộ Đề thi Giữa kì 2 Hoá học 12 Cánh diều theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Sở Giáo dục và Đào tạo ...
Đề thi Giữa kì 2 - Cánh diều
năm 2025
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề 1)
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Cho thế điện cực chuẩn của một số cặp oxi hóa – khử: ; ; ; ; . Dựa vào thông tin trên hãy cho biết kim loại nào sau đây không thể phản ứng với nước ở điều kiện chuẩn?
A. Al.
B. Mg.
C. Ni.
D. Na.
Câu 2. Khi điện phân dung dịch gồm NaCl 1,0 M và CuSO4 0,5 M, thứ tự điện phân ở anode là
A. H2O, Cl–.
B. Cl–, H2O.
C. , Cl–, H2O.
D. Cl–, , H2O.
Câu 3. Ở trạng thái cơ bản, cấu hình electron ứng với lớp ngoài cùng nào sau đây là của nguyên tố kim loại?
A. 4s24p5.
B. 3s23p4.
C. 2s22p6.
D. 3s23p1.
Câu 4. Kim loại nào sau đây là chất lỏng ở điều kiện thường?
A. Na.
B. Cs.
C. Al.
D. Hg.
Câu 5. Thành phần chính của khoáng vật hematite dùng để sản xuất gang, thép là
A. Fe3O4.
B. Fe2O3.
C. FeO.
D. FeCO3.
Câu 6. Một loại hợp kim của sắt trong đó có nguyên tố C (0,01% − 2%) và một lượng rất ít các nguyên tố Si, Mn, S, P. Hợp kim đó là
A. gang trắng.
B. thép.
C. gang xám.
D. duralumin.
Câu 7. Vỏ tàu biển được làm bằng thép, để lâu trong tự nhiên sẽ bị gỉ. Phát biểu nào sau đây không đúng?
A. Vỏ tàu bị gì chủ yếu do xảy ra ăn mòn điện hoá học.
B. Để chống sự ăn mòn vỏ tàu người ta thường phủ kín vỏ tàu bằng một lớp sơn.
C. Vỏ tàu bị ăn mòn là do sắt tác dụng với NaCl trong nước biển.
D. Người ta gắn một số tấm kẽm (Zn) vào phần chìm dưới nước của vỏ tàu để hạn chế sự ăn mòn.
Câu 8. Hạt nhân nguyên tử sodium có 11 proton và 12 neutron. Số khối của nguyên tử sodium là
A. 10.
B. 11.
C. 12.
D. 23.
Câu 9. Trong công nghiệp, phương pháp điện phân dung dịch được sử dụng để sản xuất một lượng đáng kể kim loại nào sau đây?
A. Zn.
B. Al.
C. Fe.
D. Mg.
Câu 10. Cho các kim loại Na, Ca, K, Al, Fe, Cu, số kim loại tan tốt trong dung dịch NaOH là
A. 3.
B. 4.
C. 5.
D. 6.
Câu 11. Cho các trường hợp sau: (1) Bọc đinh sắt bằng dây đồng; (2) Bọc đinh sắt bằng dây kẽm; (3) Nhúng đinh sắt vào dung dịch acid.
Trường hợp đinh sắt bị rỉ nhanh hơn là
A. (1) và (2).
B. (1) và (3).
C. (2) và (3).
D. (1), (2) và (3).
Câu 12: Một lượng lớn soda được điều chế bằng phương pháp Solvay bằng cách cho khí CO2 vào dung dịch NaCl bão hoà và NH3 bão hoà. Đặc điểm của phương pháp này là
A. ở áp suất cao, khí CO2 có thể đẩy Cl- ra khỏi muối NaCl tạo thành NaHCO3.
B. phản ứng oxi hoá - khử xảy ra trong dung dịch.
C. NaHCO3 có độ tan kém trong dung dịch phản ứng, dễ dàng kết tinh.
D. phản ứng trao đổi ưu tiên xảy ra theo chiều thuận để làm giảm số mol khí.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
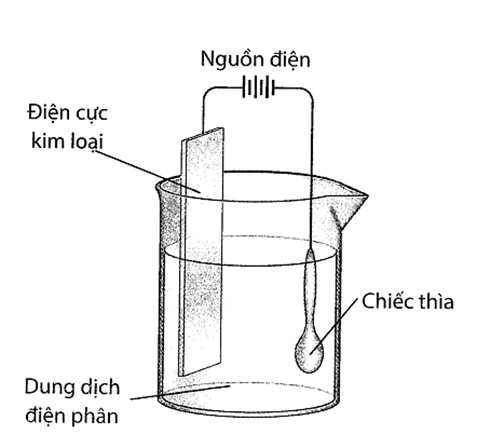
Câu 1. Sử dụng thiết bị sau với dòng điện một chiều, thực hiện mạ một chiếc thìa bằng kim loại như hình bên dưới:
Cho các phát biểu sau:
a). Bạc sẽ bám lên chiếc thìa bởi vì bạc là kim loại rất hoạt động.
b). Dung dịch điện phân là muối bạc tan tốt trong nước.
c). Điện cực kim loại được làm bằng bạc.
d). Chiếc thìa được nối với cực âm của nguồn điện.
Câu 2. Sodium chloride (NaCl) là hợp chất hóa học được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ thực phẩm đến công nghiệp và y tế.
a). Sodium chloride là thành phần chính trong muối ăn.
b). Sodium chloride được sử dụng phổ biến như là đồ gia vị và chất bảo quản thực phẩm.
c). Việc sử dụng muối ăn NaCl sẽ giúp làm giảm bệnh bướu cổ.
d). Nồng độ muối cao có thể gây ra áp lực thẩm thấu lên vi sinh vật, làm chúng khó duy trì các hoạt động sống cần thiết do vậy có thể dùng NaCl để bảo quản thực phẩm.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1. Trong phòng thí nghiệm, có thể điều chế lượng nhỏ H2 và O2 bằng phương pháp điện phân nước. Một dòng điện 1,04 A đi qua dung dịch sulfuric acid loãng trong 6,00 phút trong một thiết bị điện phân. Tổng số mol H2 và O2 thu được là (n.10-3). Giá trị của n là bao nhiêu? (Kết quả làm tròn đến hàng phần trăm).
Cho biết số mol electron đi qua hệ tính theo công thức với I là cường độ dòng điện (A), t là thời gian (giây), F = 96 500 (C mol-1) là số Faraday.
Câu 2. Cho các phát biểu sau:
a) Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
b) Trong bảng tuần hoàn, các nhóm A bao gồm các nguyên tố s và nguyên tố p.
c) Trong 1 chu kì, kim loại có bán kính nhỏ hơn phi kim.
d) Kim loại có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được.
Số phát biểu đúng là?
Câu 3. Để xác định thành phần của kim loại Al trong hợp kim Al - Mg, một bạn học sinh thực hiện thí nghiệm sau: Lấy một mẩu hợp kim chia thành 2 phần bằng nhau.
- Phần 1 cho hoà tan hoàn toàn trong dung dịch HCl, sau phản ứng thu được 9,916 lít khí H2 (đkc).
- Phần 2 cho tác dụng với dung dịch NaOH dư, sau phản ứng thu được 7,437 lít khí H2 (đkc).
Xác định thành phần phần trăm theo khối lượng của Al trong hợp kim trên.
(Làm tròn kết quả đến hàng phần trăm).
Câu 4. Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
B. Phần tự luận (3 điểm)
Bài 1:
a) Cho các pin điện hoá và sức điện động chuẩn tương ứng:
|
Pin điện hóa |
Cu-X |
Y-Cu |
Z- Cu |
|
Sức điện động chuẩn (V) |
0,46 |
1,1 |
1,47 |
(X, Y, Z là ba kim loại.)
Sắp xếp các kim loại: Cu, X, Y, Z theo chiều tăng dần tính khử từ trái sang phải.
b) Hãy giải thích trường hợp sau: Khi nối một sợi dây điện bằng đồng với một sợi dây điện bằng nhôm thì lâu ngày tại điểm nối bị bong ra.
Bài 2:
a). Có ba dung dịch NaCl, LiCl, KCl trong các lọ bị mất nhãn. Hãy nêu các phương pháp dùng để nhận biết các dung dịch trên.
b). Tiến hành điện phân với điện cực trơ có màng ngăn 200 mL dung dịch NaCl cho tới khi cathode thoát ra 0,2479 L khí (đkc) thì ngừng điện phân. Tính pH của dung dịch sau điện phân.
Đáp án và hướng dẫn giải
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
|
1.C |
2.B |
3.D |
4.D |
5.B |
6.B |
|
7.C |
8.D |
9.A |
10.B |
11.B |
12.C |
PHẦN II. Câu trắc nghiệm đúng sai.
|
Câu 1 |
S |
Đ |
Đ |
Đ |
|
Câu 2 |
Đ |
Đ |
S |
Đ |
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
2,91 |
3 |
69,23 |
26,4 |
B. Phần tự luận (3 điểm)
Bài 1:
a)
Lại có E0 càng nhỏ thì tính khử càng mạnh.
Chiều tăng dần tính khử từ trái sang phải là: X, Cu, Y, Z.
b) Không khí ẩm hoà tan CO2, SO2, H2S, ... tạo nên dung dịch điện li (H+) đọng trên chỗ tiếp xúc của hai kim loại tạo ra cặp pin, dẫn đến sự ăn mòn điện hoá xảy ra làm cho điểm nối dễ bị bong ra.
Bài 2:
a. Trích mẫu thử ba dung dịch NaCl, LiCl, KCl. Dùng phương pháp thử màu ngọn lửa để nhận biết ion kim loại kiềm:
- Muối Li+ cháy cho ngọn lửa màu đỏ tía.
- Muối Na+ cháy cho ngọn lửa màu vàng.
- Muối K+ cháy cho ngọn lửa màu tím nhạt.
b. Phương trình điện phân: 2NaCl + 2H2O 2NaOH + Cl2 + H2
Ở cực âm (cathode) thu được H2 và NaOH:
2H2O + 2e → H2 + 2OH-
=> → => pH = 13.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học 12 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Tham khảo đề thi Hóa học 12 Cánh diều có đáp án hay khác:
Để học tốt lớp 12 các môn học sách mới:
- Giải bài tập Lớp 12 Kết nối tri thức
- Giải bài tập Lớp 12 Chân trời sáng tạo
- Giải bài tập Lớp 12 Cánh diều
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

