3 Đề thi Học kì 2 Hóa học 12 Cánh diều (cấu trúc mới, có đáp án)
Với bộ 3 Đề thi Học kì 2 Hóa học 12 Cánh diều năm 2026 theo cấu trúc mới có đáp án và ma trận được biên soạn và chọn lọc từ đề thi Hóa học 12 của các trường THPT trên cả nước sẽ giúp học sinh lớp 12 ôn tập và đạt kết quả cao trong các bài thi Học kì 2 Hóa 12.
3 Đề thi Học kì 2 Hóa học 12 Cánh diều (cấu trúc mới, có đáp án)
Chỉ từ 70k mua trọn bộ Đề thi Học kì 2 Hoá học 12 Cánh diều theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Cánh diều
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề 1)
PHẦN I (4,5 điểm). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Trong quá trình điện phân KCl nóng chảy với các điện cực trơ, ở cathode xảy ra quá trình
A. oxi hóa ion K+.
B. khử ion K+.
C. oxi hóa ion Cl-.
D. khử ion Cl-.
Câu 2. Trong công nghiệp, quá trình điện phân dung dịch NaCl bão hòa (điện cực trơ, có màng ngăn xốp) tạo ra khí nào sau đây ở cathode?
A. Hydrogen.
B. Chlorine.
C. Oxygen.
D. Hydrogen chloride.
Câu 3. Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng phương pháp điện phân dung dịch với anode làm bằng
A. graphite.
B. platinum.
C. thép.
D. đồng thô.
Câu 4. Trong định nghĩa về liên kết kim loại: “Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron...(1)... với các ion...(2)... kim loại ở các nút mạng”. Các từ cần điền vào vị trí (1), (2) là
A. ngoài cùng, dương.
B. tự do, dương.
C. hóa trị, lưỡng cực.
D. hóa trị, âm.
Câu 5. Kim loại nào sau đây là chất lỏng ở điều kiện thường?
A. Na.
B. Cs.
C. Al.
D. Hg.
Câu 6. Cặp chất không xảy ra phản ứng hoá học là
A. Cu và dung dịch FeCl3.
B. Fe và dung dịch HCl.
C. Fe và dung dịch FeCl3.
D. Cu và dung dịch FeCl2.
Câu 7. Cho ba kim loại được tách từ quặng của chúng theo các cách tương ứng sau
|
Kim loại |
Phương pháp tách thông dụng |
|
X |
Điện phân nóng chảy |
|
Y |
Nhiệt phân, nung nóng trực tiếp |
|
Z |
Nung nóng với carbon |
Khả năng hoạt động hóa học của các kim loại giảm dần theo thứ tự nào sau đây?
A. Z, Y, X.
B. X, Y, Z.
C. X, Z, Y.
D. Y, Z, X.
Câu 8. Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
A. Bán kính nguyên tử giảm dần.
B. Nhiệt độ nóng chảy tăng dần.
C. Độ cứng giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Câu 9. Kim loại Na, K thường được bảo quản trong
A. dầu hoả khan.
B. phenol.
C. ethanol.
D. bình hút ẩm.
Câu 10. Một loại muối (X) của kim loại kiềm được dùng làm phân bón, cung cấp cả hai nguyên tố dinh dưỡng đa lượng cho cây trồng. Công thức hoá học của muối X là
A. KNO3
B. K2CO3
C. NaNO3
D. Na3PO4
Câu 11. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của các kim loại nhóm IIA có dạng chung là
A. ns1.
B. ns2.
C. ns2np3.
D. ns2np5.
Câu 12. Kim loại không phản ứng với nước là
A. Mg.
B. Ba.
C. Be.
D. Ca.
Câu 13. Trong các mẫu nước cứng sau đây, nước cứng tạm thời là
A. dung dịch Ca(HCO3)2.
B. dung dịch MgSO4.
C. dung dịch CaCl2.
D. dung dịch Mg(NO3)2 .
Câu 14. Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng sau đó kết tủa tan dần.
Câu 15. Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hòa?
A. Sc (Z = 21).
B. Cu (Z = 29).
C. Ni (Z = 28).
D. Mn (Z = 25).
Câu 16. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là
A. Ti.
B. Fe.
C. Cr.
D. Cu.
Câu 17. Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
A. các orbital trống.
B. cặp electron hoá trị riêng.
C. ít nhất 4 orbital trống.
D. ít nhất hai cặp electron hoá trị riêng.
Câu 18. Dạng hình học có thể có của phức chất [FeF6]3− là
A. Tứ diện.
B. Bát diện.
C. Vuông phẳng.
D. Tứ diện hoặc vuông phẳng.
PHẦN II (4 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
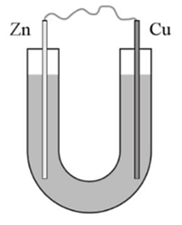
Câu 1. Thực hiện thí nghiệm sau:
Bước 1: Cho dung dịch NaCl 5% vào ống thuỷ tinh hình chữ U như hình bên.
Bước 2: Nhúng một thanh đồng và một thanh kẽm đã làm sạch vào hai đầu của ống chữ U.
Bước 3: Nối hai thanh kim loại bằng dây dẫn.
a). Sau bước 2, kim loại Zn bị ăn mòn.
b). Sau bước 3, kẽm bị ăn mòn, đồng không bị ăn mòn.
c). Sau bước 3, kẽm bị ăn mòn và đóng vai trò là cathode.
d). Khoảng vài phút sau bước 3, nhỏ vài giọt phenolphthalein vào dung dịch gần thanh đồng, thấy dung dịch dần chuyển sang màu hồng.
Câu 2. Sodium chloride (NaCl) là hợp chất hóa học được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, từ thực phẩm đến công nghiệp và y tế.
a). Sodium chloride là thành phần chính trong muối ăn.
b). Sodium chloride được sử dụng phổ biến như là đồ gia vị và chất bảo quản thực phẩm.
c). Việc sử dụng muối ăn NaCl sẽ giúp làm giảm bệnh bướu cổ.
d). Nồng độ muối cao có thể gây ra áp lực thẩm thấu lên vi sinh vật, làm chúng khó duy trì các hoạt động sống cần thiết do vậy có thể dùng NaCl để bảo quản thực phẩm.
Câu 3. Một loại nước cứng có thành phần ion như sau:
|
Ion |
Nồng độ (M) |
|
Calcium (Ca2+) |
0,02 |
|
Sodium (Na+) |
0,03 |
|
Hydrogen carbonate () |
x |
a). Nước cứng đã nêu có tính cứng vĩnh cửu.
b). Giá trị của x là 0,05.
c). Có làm mềm mẫu nước cứng trên bằng cách đun nóng.
d). Để làm mềm 1 lít nước cứng trên, cần dùng ít nhất 40 mL dung dịch NaOH 0,5 M.
Câu 4. Khi cho copper(II) hydroxide vào dung dịch NH3 dư thì hình thành phức vuông phẳng với các phối tử là NH3.
a). Công thức của phức trên là [Cu(NH3)4](OH)2.
b). Trong phức trên NH3 là phối tử còn Cu2+ là nguyên tử trung tâm.
c). Khi hình thành liên kết các phân tử NH3 đã nhận cặp electron tự do của Cu2+.
d). [Cu(NH3)4](OH)2 là chất kết tủa màu xanh thẫm.
PHẦN III (1,5 điểm). Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Nhôm (aluminium) được sản xuất bằng phương pháp điện phân Al2O3 tinh khiết. Quặng nhôm thường chứa thạch anh, silicate (chứa Si) và một số tạp chất khác cần được loại bỏ. Một loại quặng bauxite gồm Al2O3.3H2Ovà 10% kaolin Al2Si2O7.2H2O được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicate Na6Al6Si5O22.5H2O. (Làm tròn kết quả đến hàng phần trăm)
Câu 2. Ngâm một miếng kẽm sạch trong 250mL dung dịch AgNO3. Sau khi phản ứng kết thúc, lấy miếng kẽm ra khỏi dung dịch rửa sạch nhẹ bằng nước cất và sấy khô rồi đem cân thấy khối lượng miếng kẽm tăng 0,95 gam so với ban đầu. Tính nồng độ mol của dung dịch AgNO3 đã dùng.
Câu 3. Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Câu 4. Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,... Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn.
Xét một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu.
Giả thiết:
+ Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một lượng nhiệt là 1800 kJ.
+ Đốt cháy 1 kg than đá giải phóng ra một lượng nhiệt là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
+ Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Tổng khối lượng (tấn) đá vôi và than đá mà lò nung vôi trên sử dụng mỗi ngày là bao nhiêu?
Câu 5. Một mẫu chất có thành phần chính là muối Mohr. Muối Mohr có công thức hoá học là (NH4)2SO4.FeSO4.6H2O. Hoà tan 0,2151 g mẫu chất trong dung dịch sulfuric acid loãng dư, thu được dung dịch có chứa cation Fe2+. Lượng Fe2+ trong dung dịch này phản ứng vừa đủ với 5,40 mL dung dịch thuốc tím nồng độ 0,020 M (Các chất và ion khác trong dung dịch không phản ứng với thuốc tím). Xác định số mg sắt có trong mẫu chất?
Câu 6. Phức chất [MAxBy] có dạng hình học vuông phẳng. Ở đó M là nguyên tử trung tâm, x và y là số phối tử của A và B. Giá trị của x + y là bao nhiêu?
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Cánh diều
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề 2)
A. Phần trắc nghiệm (7 điểm)
PHẦN I (3 điểm). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Trong công nghiệp, phương pháp điện phân dung dịch được sử dụng để sản xuất một lượng đáng kể kim loại nào sau đây?
A. Zn.
B. Na.
C. Ca.
D. Mg.
Câu 2. Ở trạng thái cơ bản, cấu hình electron ứng với lớp ngoài cùng nào sau đây là của nguyên tố kim loại?
A. 1s2.
B. 3s23p3.
C. 2s22p6.
D. 3s1.
Câu 3. Kim loại có tính dẫn nhiệt, dẫn điện, tính dẻo, ánh kim là do
A. kim loại có cấu trúc mạng tinh thể.
B. kim loại có tỉ khối lớn.
C. các electron tự do trong kim loại gây ra.
D. kim loại có bán kính nguyên tử và điện tích hạt nhân nhỏ.
Câu 4. Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại nào sau đây?
A. Sn.
B. Pb.
C. Zn.
D. Cu.
Câu 5. Trong tự nhiên, calcium sulfate tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
A. vôi sống.
B. vôi tôi.
C. thạch cao sống.
D. đá vôi.
Câu 6. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là
A. Fe.
B. Ti.
C. Cu.
D. Mn.
Câu 7. Cho phát biểu đúng nhất về dạng hình học có thể có của phức chất có dạng tổng quát [ML4]
A. Tứ diện.
B. Bát diện.
C. Vuông phẳng.
D. Tứ diện hoặc vuông phẳng.
Câu 8. Cho phát biểu sau: “Khi tan trong nước, muối của các kim loại chuyển tiếp …(1)… thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kết cho − nhận, tạo ra phức chất aqua có dạng tổng quát là ...(2)....”
Cụm từ cần điền vào (1) và (2) lần lượt là
A. điện li, [M(H2O)n]+.
B. điện li, [M(H2O)m]n+.
C. điện phân, [M(H2O)m]n+.
D. phân li, [M(H2O)n]+.
Câu 9. Các kim loại đều tác dụng được với dung dịch HCl nhưng không tác dụng với dung dịch HNO3 đặc, nguội?
A. Fe, Mg, Al.
B. Cu, Fe, Al.
C. Cu, Pb, Ag.
D. Fe, Al, Cr.
Câu 10. Muối nào sau đây vừa có khả năng thể hiện tính oxi hóa (trong môi trường acid), vừa có khả năng thể hiện tính khử (trong môi trường kiềm)?
A. K2Cr2O7.
B. Cr2(SO4)3.
C. K2CrO4.
D. Na2CrO4.
Câu 11. Nguyên tử trung tâm của phức [Co(NH3)6]3+ là ?
A. N.
B. Co.
C. Co3+.
D. NH3.
Câu 12. Phức chất [Cu(H2O)6]2+có màu xanh; phức chất [Cu(NH3)4(H2O)2] có màu xanh lam và phức chất [CuCl4]2− có màu vàng. Màu sắc của ba phức chất khác nhau là do chúng khác nhau về
A. nguyên tử trung tâm.
B. phối tử.
C. cả nguyên tử trung tâm và phối tử.
D. số lượng phối tử.
PHẦN II (2 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 1. Trong bảng Hệ thống tuần hoàn, sodium (IA) và magnesium (IIA) đứng kề nhau trong một chu kì. Thế điện cực chuẩn của cặp Mg2+/Mg bằng –2,356 V, của cặp Na+/Na bằng –2,710 V.
a. Mg và Na là các kim loại có tính khử mạnh.
b. Mg có tính khử mạnh hơn Na.
c. Mg và Na đều phản ứng mãnh liệt với nước ở điều kiện thường.
d. Ion Mg2+ có tính oxi hóa mạnh hơn ion Na+.
Câu 2. Một phức chất có công thức [Fe(H2O)6](NO3)3.
a. Nguyên tử trung tâm là cation Fe2+.
b. Phối tử là .
c. Trong phức chất trên nguyên tử Fe chiếm 16% về khối lượng.
d. Tỉ lệ khối lượng của phối tử và nguyên tử trung tâm là 14 : 27.
PHẦN III (2 điểm). Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1. Điện phân dung dịch CuCl2 trong 1 giờ với dòng điện 5A. Sau điện phân, dung dịch còn CuCl2 dư. Khối lượng Cu đã sinh ra tại cathode của bình điện phân là bao nhiêu gam? (Cho Cu = 64). (Làm tròn kết quả đến hàng phần trăm)
Câu 2. Ở 20oC, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
Câu 3. Phân tử ethylamine (C2H5NH2) có số cặp electron chưa liên kết là?
Câu 4. Trong y học, dược phẩm dạng sữa Magnesium (các tinh thể Mg(OH)2 lơ lửng trong nước) dùng để chữa chứng khó tiêu do dư hydrochloric acid HCl. Để trung hòa hết 788,0 mL dung dịch HCl 0,035 M trong dạ dày cần bao nhiêu mL sữa Magnesium, biết trong 1,0 mL sữa Magnesium có chứa 0,08 gam Mg(OH)2. (Làm tròn kết quả đến hàng phần mười).
B. Phần tự luận (3 điểm)
Bài 1. (1,5 điểm)
a. (0,5 điểm) Hãy giải thích trường hợp sau: Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn chặt những tấm kẽm vào phần vỏ tàu ngâm trong nước biển.
b. (1 điểm) Cho 200 mL dung dịch Ba(OH)2 0,1 M vào 300 mL dung dịch NaHCO3 0,1 M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25 M vào X đến khi bắt đầu có khí sinh ra thì hết V mL. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là bao nhiêu?
Bài 2 (1,5 điểm):
a. (0,5 điểm): Tại sao đơn chất của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng lớn hơn đơn chất của các nguyên tố họ s cùng chu kì?
b. (1 điểm): Dự đoán hiện tượng xảy ra, mô tả sự thay thế phối tử khi cho từ từ đến dư dung dịch ammonia vào dung dịch muối nickel(II) chloride. Viết phương trình hoá học của các phản ứng.
Đáp án và hướng dẫn giải
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
|
1.A |
2.D |
3.C |
4.C |
5.C |
6.C |
|
7.D |
8.B |
9.D |
10.B |
11.C |
12.B |
PHẦN II. Câu trắc nghiệm đúng sai.
|
Câu 1 |
Đ |
S |
S |
Đ |
|
Câu 2 |
S |
S |
Đ |
S |
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
5,97 |
26,4 |
1 |
10 |
B. Phần tự luận (3 điểm)
Bài 1.
a.
Đây là cách chống ăn mòn bằng phương pháp điện hoá, khi Zn và Fe cùng tiếp xúc với nước biển (dung dịch điện li), Zn sẽ bị ăn mòn trước và bảo vệ cho thành vỏ tàu.
b.
Dung dịch X có: OH− dư 0,01 mol và CO32−: 0,01 mol
Cho từ từ H+ vào X đến khi bắt đầu có khí sinh ra:
=> V = = 0,08L = 80mL.
Bài 2
a.
Các nguyên tố kim loại chuyển tiếp dãy thứ nhất có nguyên tử khối lớn hơn, bán kính nguyên tử nhỏ hơn so với các nguyên tố họ s cùng chu kì. Do đó đơn chất của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng lớn hơn đơn chất của nguyên tố họ s cùng chu kì.
b.
Hiện tượng: Dung dịch NiCl2, có màu lục, khi nhỏ thêm NH3, sẽ xuất hiện kết tủa màu lục, tiếp tục nhỏ đến dư NH3, kết tủa sẽ tan và tạo thành dung dịch có màu tím.
Kết tủa bị hoà tan là do đã tạo thành phức chất [Ni(NH3)6]2+. Trong dung dịch NiCl2 tồn tại phức aqua [Ni(H2O)6]2+, khi nhỏ đến dư NH3, sẽ có sự thay thế phối tử H2O bằng phối tử NH3.
Phương trình hoá học của các phản ứng:
[Ni(H₂O)6]²+(aq) + 2NH3(aq) → [Ni(H2O)4(OH)2] (s) + 2NH4+ (aq)
[Ni(H₂O)4(OH)₂](s) + 6NH3(aq) → [Ni(NH3)6]²+(aq) + 2OH-(aq) + 4H2O(l).
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học 12 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Tham khảo đề thi Hóa học 12 Cánh diều có đáp án hay khác:
Để học tốt lớp 12 các môn học sách mới:
- Giải bài tập Lớp 12 Kết nối tri thức
- Giải bài tập Lớp 12 Chân trời sáng tạo
- Giải bài tập Lớp 12 Cánh diều
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12















 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

