3 Đề thi Học kì 2 Hóa học 12 Kết nối tri thức (cấu trúc mới, có đáp án)
Với bộ 3 Đề thi Học kì 2 Hóa học 12 Kết nối tri thức năm 2026 theo cấu trúc mới có đáp án và ma trận được biên soạn và chọn lọc từ đề thi Hóa học 12 của các trường THPT trên cả nước sẽ giúp học sinh lớp 12 ôn tập và đạt kết quả cao trong các bài thi Học kì 2 Hóa 12.
3 Đề thi Học kì 2 Hóa học 12 Kết nối tri thức (cấu trúc mới, có đáp án)
Chỉ từ 70k mua trọn bộ Đề thi Học kì 2 Hoá học 12 Kết nối tri thức theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề 1)
PHẦN I (4,5 điểm). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Khi điện phân NaCl nóng chảy (điện cực trơ), ở cathode xảy ra?
A. Sự khử ion Cl−.
B. Sự oxi hóa ion Cl−.
C. Sự oxi hóa ion Na+.
D. Sự khử ion Na+.
Câu 2. Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ?
A. NaBr.
B. NaCl.
C. CuSO4.
D. CuCl2.
Câu 3. Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình
A. Ag → Ag++ 1e.
B. Fe → Fe2++ 2e.
C. 2H2O → 4H++ O2 + 4e.
D. C → C4++ 4e.
Câu 4. Trong mạng tinh thể kim loại, liên kết kim loại được hình thành do
A. sự góp chung electron của các nguyên tử kim loại cạnh nhau.
B. lực hút tĩnh điện giữa các electron hóa trị ở các nút mạng với các ion dương kim loại chuyển động tự do.
C. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại chuyển động tự do trong toàn bộ mạng tinh thể.
D. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại ở các nút mạng.
Câu 5. Kim loại X là kim loại nhẹ, dẫn điện tốt và có lớp màng oxide bền vững bảo vệ nên được sử dụng rộng rãi làm dây dẫn điện ngoài trời. Kim loại X là
A. sắt.
B. bạc.
C. đồng.
D. nhôm.
Câu 6. Một mẫu kim loại Cu có lẫn tạp chất là các kim loại Al, Mg. Để loại bỏ tạp chất thì dùng dung dịch nào sau đây?
A. NaOH.
B. Cu(NO3)2.
C. Fe(NO3)3.
D. Fe(NO3)2.
Câu 7. Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4 và CuO, thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. Mg, Fe, Cu.
B. Mg, Al, Fe, Cu.
C. MgO, Fe, Cu.
D. MgO, Fe3O4, Cu.
Câu 8. Nguyên tử của các nguyên tố nhóm IA khác nhau về
A. số electron lớp ngoài cùng của nguyên tử.
B. cấu hình electron nguyên tử.
C. số oxi hóa của nguyên tử trong hợp chất.
D. kiểu mạng tinh thể của đơn chất.
Câu 9. Soda là hoá chất quan trọng trong sản xuất thuỷ tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức hoá học của soda là
A. NaCl.
B. Na2SO4
C. NaNO3
D. Na2CO3
Câu 10. Hợp chất A tan nhiều trong nước; khi được đốt cháy trên ngọn lửa đèn khí thì tạo ra ngọn lửa màu vàng; khi tan trong dung dịch hydrochloric acid tạo ra khí, khí này làm đục nước vôi trong. Hợp chất A có thể là
A. K2CO3.
B. Na2CO3.
C. CaCO3hoặc Ca(HCO3)2
D. Na2CO3 hoặc NaHCO3
Câu 11. Nước cứng không gây tác hại nào sau đây?
A. Làm giảm khả năng tẩy rửa của xà phòng, làm cho quần áo mau mục nát.
B. Gây lãng phí nhiên liệu và mất an toàn cho các nồi hơi, làm tắc các đường ống nước nóng.
C. Gây ngộ độc cho nước uống.
D. Làm hỏng dung dịch pha chế, làm thực phẩm lâu chín và giảm mùi vị của thực phẩm.
Câu 12. Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 13. Cho sơ đồ chuyển hoá sau:
CaO Y CaCO3 T CaSO4
Biết: X, Y, Z, T, E là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học. Các chất Z, E thoả mãn sơ đồ trên lần lượt là
A. Na2CO3, H2SO4.
B. CO2, KHSO4.
C. NaHCO3, Na2SO4.
D. CO2, BaSO4.
Câu 14. Trong cốc nước chứa 0,01 mol Na+; 0,02 mol Ca2+; 0,01 mol Mg2+; 0,05 mol HCO3− và 0,02 mol Cl−. Đun sôi cốc nước hồi lâu, nước thu được là
A. nước cứng tạm thời.
B. nước mềm.
C. nước cứng vĩnh cửu.
D. nước cứng toàn phần.
Câu 15. Trong dãy kim loại chuyển tiếp thứ nhất, hai kim loại nào sau đây đều là kim loại nhẹ (D < 5g/cm3)?
A. Cr, Mn.
B. Fe, Co.
C. Sc, Ti.
D. Ni, Cu.
Câu 16. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là
A. Fe.
B. Ti.
C. Cu.
D. Mn.
Câu 17. Cho phát biểu sau: “Phức chất đơn giản thường có một ...(1)... liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ...(2)....”. Cụm từ cần điền vào (1) và (2) lần lượt là
A. cation kim loại, ion.
B. nguyên tử kim loại, cho − nhận.
C. nguyên tử trung tâm, cho − nhận.
D. phối tử, ion.
Câu 18. Số lượng phối tử có trong mỗi phức chất [PtCl4]2− và [Fe(CO)5] là
A. 4 và 5.
B. 5 và 6.
C. 5 và 2.
D. 1 và 2.
PHẦN II (4 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
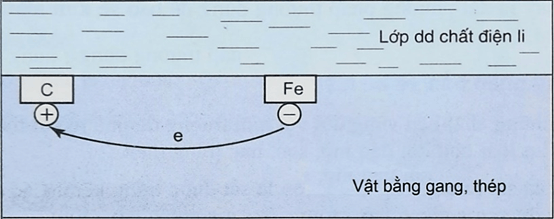
Câu 1. Trong không khí ẩm, trên bề mặt của gang, thép luôn có một lớp nước rất mỏng. Lớp nước này hoà tan khí oxygen và carbon dioxide trong khí quyển, tạo thành dung dịch chất điện li. Gang, thép có thành phần chính là sắt và carbon cùng tiếp xúc với dung dịch chất điện li tạo nên vô số pin rất nhỏ mà sắt là anode và carbon là cathode.
a). Carbon bị khử tại cathode.
b). Tại anode, Fe bị oxi hóa thành Fe2+
c). Oxygen đóng vai trò là chất oxi hóa.
d). Dạng ăn mòn hóa học là chủ yếu, do sắt dễ dàng phản ứng oxygen trong không khí.
Câu 2. Thực hiện thí nghiệm: Đốt muối của một số kim loại kiềm
Bước 1: Lấy mẫu muối LiCl, NaCl và KCl cho vào các chén sứ có đánh số lần lượt là 1, 2, 3.
Bước 2: Cho khoảng 3−5 mL alcohol C2H5OH nguyên chất vào mỗi chén sứ.
Bước 3: Đốt cháy các mẫu muối trong chén sứ trên.
a). Sau bước 3, cả 3 chén đều cháy và cho các màu ngọn lửa khác nhau.
b). Sau bước 2 các mẫu muối tan một phần trong alcohol
c). Trình tự màu của 3 ngọn lửa lần lượt là: màu tím, màu vàng và màu đỏ tía.
d). Có thể dùng thí nghiệm này để nhận biết các hợp chất khác của hợp chất kim loại kiềm.
Câu 3. Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt:
MCO3(s) MO (s) + CO2 (g)
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau:
|
Muối |
MgCO3 (s) |
CaCO3 (s) |
SrCO3 (s) |
BaCO3 (s) |
|
∆rH˚298 (kJ) |
100,70 |
179,20 |
234,60 |
271,50 |
a). Phản ứng phân hủy muối carbonate của các kim loại nhóm IIA trên đều là phản ứng thuận lợi về mặt năng lượng.
b). Độ bền nhiệt các muối carbonate của kim loại nhóm IIA tăng dần khi số hiệu nguyên tử của M tăng dần.
c). Khi để vôi bột (thành phần chính là CaO) lâu ngoài không khí có hiện tượng vôi bột dần bị chuyển hóa lại thành đá vôi (thành phần chính là CaCO3).
d). Để sản xuất 1 tấn vôi bột theo phương pháp thủ công, người ta nung đá vôi (có hàm lượng CaCO3 là 72%, còn lại là tạp chất trơ) với than đá (giả sử chỉ chứa carbon và tạp chất trơ), biết = 393,50 kJ.mol−1. Khi đó, thể tích khí CO2 tối thiểu đã thải ra môi trường ở điều kiện chuẩn nhiều hơn 82,0 m3.
Câu 4. Xét phức chất [Ni(NH3)6]2+
a). Phức chất có thể có dạng hình học tứ diện hoặc vuông phẳng.
b). Liên kết trong phức chất được hình thành là do phối tử NH3 cho cặp eletron chưa liên kết vào nguyên tử trung tâm Ni+.
c). Nguyên tử trung tâm trong phức là Ni2+.
d). Điện tích của phức chất là +2.
PHẦN III (1,5 điểm). Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Hiện nay mạ điện được sử dụng rộng rãi trong thực tế, mạ điện là quá trình phủ một lớp kim loại lên bề mặt kim loại khác bằng phương pháp điện phân. Giả sử người ta cần mạ Ag lên một mặt của một chiếc đĩa kim loại hình tròn có bán kính 20cm, độ dày lớp mạ là 0,01 mm. Nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2A thì thời gian cần dùng là t giờ. Biết rằng khối lượng riêng của Ag là 10,5 g/cm3; π = 3,14; hằng số Faraday (F = 96 500 C/mol); hiệu suất điện phân là 100%. Giá trị của t là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)
Câu 2. Tiến hành các thí nghiệm sau:
(1) Cho Mg vào lượng dư dung dịch FeCl3.
(2) Cho Ba vào lượng dư dung dịch CuSO4.
(3) Cho Zn vào dung dịch CuSO4.
(4) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Số thí nghiệm thu được kim loại là?
Câu 3. NaHCO3 được sử dụng làm bột nở do dễ phân hủy thành khí và hơi tạo ra các lỗ xốp trong bánh. Nếu sử dụng 8,4 gam NaHCO3 thì có thể tạo ra tối đa bao nhiêu lít khí CO2 (đkc)? (Làm tròn kết quả đến hàng phần trăm).
Câu 4. Làm mềm 10m3 nước cứng có tổng nồng độ Mg2+ và Ca2+ là 5,5 mmol/L bằng Na2CO3 , thu được nước có tổng nồng độ Mg2+ và Ca2+ là 1,5 mmol/L. Coi toàn bộ lượng Na2CO3 cho vào đều chuyển hết thành kết tủa CaCO3 và MgCO3. Khối lượng Na2CO3 đã dùng là bao nhiêu kg? (Làm tròn kết quả đến hàng phần trăm)
Câu 5. Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (Cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
|
Lần chuẩn độ |
1 |
2 |
3 |
|
V dung dịch KMnO4 (ml) |
16,0 |
16,1 |
16,0 |
Theo kết quả chuẩn độ ở trên, hãy tính độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr? (Làm tròn kết quả đến hàng phần mười)
Câu 6. Cho phức chất [PtCl4]2−, nguyên tử trung tâm Pt tạo bao nhiêu liên kết s với phối tử Cl−?
Sở Giáo dục và Đào tạo ...
Đề thi Học kì 2 - Kết nối tri thức
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: phút
(Đề 2)
A. Phần trắc nghiệm (7 điểm)
PHẦN I (3 điểm). Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Khi điện phân dung dịch NaCl có màng ngăn, các chất được tạo ra ở anode (cực dương) và cathode (cực âm) lần lượt là
A. Cl2 và NaOH, H2.
B. Na và Cl2.
C. Cl2 và Na.
D. NaOH và H2.
Câu 2. Trong mạng tinh thể kim loại, liên kết kim loại được hình thành do
A. sự góp chung electron của các nguyên tử kim loại cạnh nhau.
B. lực hút tĩnh điện giữa các electron hóa trị ở các nút mạng với các ion dương kim loại chuyển động tự do.
C. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại chuyển động tự do trong toàn bộ mạng tinh thể.
D. lực hút tĩnh điện giữa các electron hóa trị tự do với các ion dương kim loại ở các nút mạng.
Câu 3. Tính chất nào của thủy ngân giúp nó được sử dụng trong nhiệt kế?
A. Có độc tính mạnh.
B. Có khối lượng riêng nặng hơn nước.
C. Có nhiệt độ nóng chảy thấp hơn nhiệt độ phòng.
D. Có nhiệt độ sôi thấp hơn nhiệt độ phòng.
Câu 4. Đồng thau là một hợp kim của
A. đồng và thiếc.
B. đồng và nickel.
C. đồng và aluminium.
D. đồng và kẽm.
Câu 5. Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 6. Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
A. Tăng dần.
B. Không đổi.
C. Giảm dần.
D. Không có quy luật.
Câu 7. Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
A. các orbital trống.
B. cặp electron hoá trị riêng.
C. ít nhất 4 orbital trống.
D. ít nhất hai cặp electron hoá trị riêng.
Câu 8. Phối tử H2O trong phức chất aqua [Cu(H2O)6]2+ có thể bị thế bởi 1 phối tử NH3 tạo thành phức chất là
A. [Cu(NH3)6]2+.
B. [Cu(NH3)2(H2O)5].
C. [Cu(NH3)(H2O)5]2+.
D. [Cu(NH3)(H2O)5].
Câu 9. Một mẫu kim loại Cu có lẫn tạp chất là các kim loại Al, Mg. Để loại bỏ tạp chất thì dùng dung dịch nào sau đây?
A. NaOH.
B. Cu(NO3)2.
C. Fe(NO3)3.
D. Fe(NO3)2.
Câu 10. Cấu hình electron nào sau đây là của ion Fe2+?
A. [Ar]3d6.
B. [Ar]3d5.
C. [Ar]3d4.
D. [Ar]3d3.
Câu 11. Số lượng phối tử có trong mỗi phức chất [PtCl4]2− và [Fe(CO)5] là
A. 4 và 5.
B. 5 và 6.
C. 5 và 2.
D. 1 và 2.
Câu 12. Khi nhỏ vài giọt dung dịch NH3 vào ống nghiệm chứa AgCl thu được phức chất X. Phát biểu nào dưới đây là đúng?
A. Phức chất X có công thức là [Ag(NH3)2]+.
B. Dấu hiệu chứng tỏ phức chất X được tạo thành là có sự xuất hiện kết tủa.
C. Phức chất X có nguyên tử trung tâm là NH3.
D. Phức chất X không mang điện tích và tan tốt trong nước.
PHẦN II (2 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 1. Một số hợp chất của kim loại kiềm, kiềm thổ như sodium chloride, sodium hydroxide, sodium carbonate (soda), thạch cao, đá vôi, vôi sống, … có nhiều ứng dụng trong đời sống và sản xuất.
a. Trong quá trình sản xuất soda theo phương pháp Solvay có tạo ra muối sodium hydrogencarbonate, muối này được tách ra khỏi hỗn hợp phản ứng nhờ khả năng tan tốt trong nước của nó.
b. Khoáng vật dolomite có thành phần chính là Ca2(PO4)3.
c. Thạch cao được dùng làm vật liệu xây dựng, phấn viết bảng, … thành phần hóa học chính của thạch cao là .
d. Các muối carbonate và muối nitrate của các kim loại Mg, Ca, Sr, Ba đều bị nhiệt phân.
Câu 2. Phức chất X có công thức cấu tạo như hình bên dưới.
a. Số oxi hoá của nguyên tử trung tâm trong phức chất X là +2.
b. Công thức của phức chất X là .
c. Phức chất X thuộc loại phức bát diện.
d. Trong phức chất X, nguyên tử trung tâm iron liên kết với 6 phối tử oxalato .
PHẦN III (2 điểm). Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1. Cho các kim loại sau: Na, Ca, Fe, Al, Zn, Cu, Ag. Có bao nhiêu kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng?
Câu 2. Cho 1,9 gam hỗn hợp gồm muối carbonate và hydrocarbonate của một kim loại kiềm M. Tác dụng với dung dịch HCl dư thu được 0,496 lít khí (đkc). Khối lượng nguyên tử kim loại kiềm M là bao nhiêu amu?
Câu 3. Cho phức chất [PtCl4]2−, nguyên tử trung tâm Pt tạo bao nhiêu liên kết s với phối tử Cl−?
Câu 4. Theo Quy chuẩn Việt Nam QCVN 01−1:2018/BYT về chất lượng nước sinh hoạt, độ cứng tối đa cho phép (quy về CaCO3) là 300 mg/L. Theo quy chuẩn này, tổng nồng độ ion Ca2+ và Mg2+ gây nên tính cứng trong nước sinh hoạt không vượt quá x.10−3 M. Giá trị của x là bao nhiêu?
B. Phần tự luận (3 điểm)
Bài 1. (1,5 điểm)
a. (0,5 điểm) Hãy giải thích trường hợp sau: Để bảo vệ vỏ tàu biển làm bằng thép, người ta gắn chặt những tấm kẽm vào phần vỏ tàu ngâm trong nước biển.
b. (1 điểm) Cho 200 mL dung dịch Ba(OH)2 0,1 M vào 300 mL dung dịch NaHCO3 0,1 M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25 M vào X đến khi bắt đầu có khí sinh ra thì hết V mL. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là bao nhiêu?
Bài 2 (1,5 điểm):
a. (0,5 điểm): Tại sao đơn chất của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng lớn hơn đơn chất của các nguyên tố họ s cùng chu kì?
b. (1 điểm): Dự đoán hiện tượng xảy ra, mô tả sự thay thế phối tử khi cho từ từ đến dư dung dịch ammonia vào dung dịch muối nickel(II) chloride. Viết phương trình hoá học của các phản ứng.
Đáp án và hướng dẫn giải
A. Phần trắc nghiệm (7 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn.
|
1.A |
2.D |
3.C |
4.D |
5.B |
6.C |
|
7.B |
8.C |
9.B |
10.A |
11.A |
12.A |
PHẦN II. Câu trắc nghiệm đúng sai.
|
Câu 1 |
S |
S |
Đ |
Đ |
|
Câu 2 |
S |
Đ |
Đ |
S |
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
3 |
23 |
4 |
3 |
B. Phần tự luận (3 điểm)
Bài 1. (1,5 điểm)
a.
Đây là cách chống ăn mòn bằng phương pháp điện hoá, khi Zn và Fe cùng tiếp xúc với nước biển (dung dịch điện li), Zn sẽ bị ăn mòn trước và bảo vệ cho thành vỏ tàu.
b.
Dung dịch X có: OH− dư 0,01 mol và CO32−: 0,01 mol
Cho từ từ H+ vào X đến khi bắt đầu có khí sinh ra:
=> V = = 0,08L = 80mL.
Bài 2 (1,5 điểm):
a.
Các nguyên tố kim loại chuyển tiếp dãy thứ nhất có nguyên tử khối lớn hơn, bán kính nguyên tử nhỏ hơn so với các nguyên tố họ s cùng chu kì. Do đó đơn chất của các nguyên tố kim loại chuyển tiếp dãy thứ nhất có khối lượng riêng lớn hơn đơn chất của nguyên tố họ s cùng chu kì.
b.
Hiện tượng: Dung dịch NiCl2, có màu lục, khi nhỏ thêm NH3, sẽ xuất hiện kết tủa màu lục, tiếp tục nhỏ đến dư NH3, kết tủa sẽ tan và tạo thành dung dịch có màu tím.
Kết tủa bị hoà tan là do đã tạo thành phức chất [Ni(NH3)6]2+. Trong dung dịch NiCl2 tồn tại phức aqua [Ni(H2O)6]2+, khi nhỏ đến dư NH3, sẽ có sự thay thế phối tử H2O bằng phối tử NH3.
Phương trình hoá học của các phản ứng:
[Ni(H₂O)6]²+(aq) + 2NH3(aq) → [Ni(H2O)4(OH)2] (s) + 2NH4+ (aq)
[Ni(H₂O)4(OH)₂](s) + 6NH3(aq) → [Ni(NH3)6]²+(aq) + 2OH-(aq) + 4H2O(l).
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi Hóa học 12 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Tham khảo đề thi Hóa học 12 Kết nối tri thức có đáp án hay khác:
Để học tốt lớp 12 các môn học sách mới:
- Giải bài tập Lớp 12 Kết nối tri thức
- Giải bài tập Lớp 12 Chân trời sáng tạo
- Giải bài tập Lớp 12 Cánh diều
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12

















 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

