78+ đề thi học sinh giỏi Hóa học 12 năm 2025-2026 (có lời giải)
Bộ đề thi học sinh giỏi Hóa học 12 năm 2025-2026 chương trình sách mới có lời giải gồm 29 đề thi hsg Hóa 12 năm 2025-2026, 49 đề thi hsg Hóa 12 năm 2024-2025 và tặng kèm 30 đề HSG Hóa 12 năm 2022-2023 có lời giải) giúp học sinh ôn tập và đạt kết quả cao trong bài thi HSG Hóa 12.
78+ đề thi học sinh giỏi Hóa học 12 năm 2025-2026 (có lời giải)
Chỉ từ 200k mua trọn bộ Đề thi học sinh giỏi Hóa 12 theo cấu trúc mới bản word có lời giải chi tiết:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận đề thi
Đề thi học sinh giỏi Hóa học 12 trường THPT Hàn Thuyên (Bắc Ninh) năm 2025-2026
Đề thi học sinh giỏi Hóa học 12 Liên trường THPT (Nghệ An) năm 2025-2026
Đề thi học sinh giỏi Hóa học 12 Cụm các trường THPT (Hải Phòng) năm 2025-2026
Đề thi học sinh giỏi Hóa học 12 Cụm 09 trường THPT (Phú Thọ) năm 2025-2026
Đề thi học sinh giỏi Hóa học 12 trường THPT Trực Ninh (Ninh Bình) năm 2025-2026
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Hà Nội năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Nam Định năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Vĩnh Phúc năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Hà Tĩnh năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Quảng Ninh năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Khánh Hòa năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Hải Phòng năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Thái Bình năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Thái Nguyên năm 2024-2025
Đề thi học sinh giỏi Hóa học 12 Sở GD&ĐT Bắc Ninh năm 2024-2025
|
SỞ GD & ĐT NINH BÌNH TRƯỜNG THPT TRỰC NINH (Đề thi gồm 08 trang) |
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG NĂM HỌC 2025 - 2026 Môn: Hóa học – Lớp: 12 THPT Thời gian làm bài: 90 phút. |
Họ và tên: ............................................................................ |
Số báo danh: ....... |
Cho: . H=1; He=4; C=12; N=14; O=16; Na=23; Mg=24; Al= 27; P=31; S=32; Cl=35,5; K=39; Ca=40; Fe= 56; Cu=64; Zn = 65; Br=80; Ag=108; Ba=137.
PHẦN I. Trắc nghiệm nhiều phương án lựa chọn (8 điểm).
Câu 1. Trạng thái lai hóa của nguyên tử nitrogen trong phân tử NH3 là
A. sp3.
B. sp2.
C. sp.
D. sp3d.
Câu 2. Để tìm hiểu một loại dầu gội có thành phần đúng như quảng cáo in trên nhãn hay không, một học sinh lần lượt tiến hành các bước thí nghiệm sau:
- Cho 1 mL dầu gội vào ống nghiệm chứa sẵn 5 mL nước, khuấy đều và nhẹ.
- Thêm tiếp 2 mL dung dịch KOH 0,1M vào ống.
- Tiếp tục thêm 2 giọt dung dịch CuSO4 0,1M vào ống, khuấy đều.
Sau 2 phút, dung dịch trong ống nghiệm hóa tím. Thành phần cần xác định trong mẫu dầu gội nói trên là
A. glucose.
B. chất béo.
C. collagen.
D. sodium hydroxide.
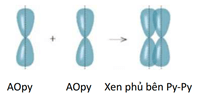
Câu 3. Cho sơ đồ xen phủ orbital nguyên tử như hình vẽ dưới đây:
Đây là sự tạo thành liên kết nào trong phân tử ethylene?
A. Liên kết σ giữa nguyên tử C với nguyên tử H.
B. Liên kết π giữa nguyên tử C với nguyên tử C.
C. Liên kết π giữa nguyên tử C với nguyên tử H.
D. Liên kết σ giữa nguyên tử C với nguyên tử C
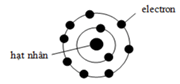
Câu 4. Hình vẽ dưới đây minh họa sự phân bố electron của ion X2+:
Vị trí của X trong bảng tuần hoàn các nguyên tố hóa học là
A. Ô số 10, chu kì 3, nhóm VIIIA.
B. Ô số 10, chu kì 2, nhóm VIIIA.
C. Ô số 12, chu kì 2, nhóm IIA.
D. Ô số 12, chu kì 3, nhóm IIA.
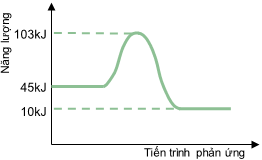
Câu 5. Cho đồ thị biểu diễn năng lượng hoạt hóa của một phản ứng như sau:
Năng lượng hoạt hóa của phản ứng trên là
A. 10 kJ.
B. 45 kJ.
C. 93 kJ.
D. 58 kJ.
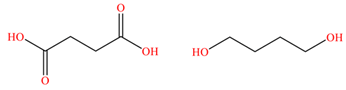
Câu 6. PBS - Poly(butylene succinate) là một polymer phân huỷ sinh học có tínhdẻo và bền nhiệt tương tự polyethylene (PE). PBS được ứng dụng rộng rãi trong sản xuất bao bì và túi nylon thân thiện với môi trường, trở thành giải pháp tiềm năng thay thế các loại nhựa truyền thống khó phân huỷ. PBS được tổng hợp bằng phản ứng trùng ngưng giữa haimonomer sau:
Khối lượng của một mắt xích PBS (theo đơn vị amu) có giá trị là
A. 172.
B. 190.
C. 208.
D. 200.
Câu 7. Nguyên tử carbon bất đối là nguyên tử carbon liên kết với 4 nguyên tử hoặc nhóm nguyên tử khác nhau. Số nguyên tử carbon bất đối trong một phân tử glucose dạng mạch hở là
A. 4.
B. 3.
C. 2.
D. 5.
Câu 8. Quá trình reforming là quá trình sắp xếp lại mạch hydrocarbon để tạo ra nhiều hydrocarbon mạch nhánh, làm tăng chỉ số octane của xăng hoặc tạo ra các hợp chất arene như benzene, toluene, xylene để làm nguyên liệu cho hóa dầu. Cho các quá trình nào sau đây:
(1) Hexane isohexane.
(2) Ethylbenzen 1,2-dimethylbenzene.
(3) Octane Butane + But-1-ene.
(4) Octane 2,2,4-trimethylpentane
Có bao nhiêu phản ứng thuộc quá trình reforming?
A. 1.
B. 3.
C. 4.
D. 2.
Câu 9. Tên thay thế của amine có công thức cấu tạo như hình bên dưới là
A. N-methyl-1,3-dimethylbutan-1-amine.
B. N-methyl-4-methylpentan-2-amine.
C. N-methyl-3-isopropylpropanamine.
D. methyl-4-methylpentan-2-amine.
Câu 10. Trong đông y, sau khi phơi khô, để bảo quản các loại dược liệu trong thời gian lâu ngày khỏi bị nấm, mốc…. người ta sử dụng chất hóa học X để xông hơi. Đặt chất X vào bát sứ, châm lửa rồi đặt giữa đống dược liệu để chất X cháy âm ỉ, chuyển hóa thành chất Y rồi buộc bạt, bao ni lông phủ kín xung quanh để chất Y tỏa ra vào mọi ngóc ngách của dược liệu. Chất X và Y lần lượt là
A. sulfur và sulfur dioxide.
B. phosphorus và diphosphorus pentaoxide.
C. carbon và carbon dioxie.
D. carbon và carbon monoxide.
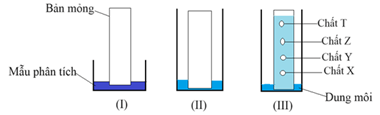
Câu 11. Sắc kí lớp mỏng được ứng dụng rộng rãi trong nhiều lĩnh vực như: xét nghiệm độ tinh khiết của các hóa chất phóng xạ hay thử tinh khiết, bán định lượng hoặc định lượng các hoạt chất thuốc,... Ban đầu, bản mỏng được nhúng vào mẫu (giai đoạn I) tiếp sau đó đem nhúng bản mỏng trong dung môi (giai đoạn II), dung môi sẽ dịch chuyển dần lên phía trên và kéo theo các chất trong mẫu lên (hình III).
Chất nào bị bản mỏng hấp phụ mạnh nhất?
A. chất Y.
B. chất X.
C. chất Z.
D. chất T.
Câu 12. Cho giá trị thế cực chuẩn của các cặp oxi hoá - khử
Cặp oxi hoá - khử |
Mg2+/Mg |
H+/H2 |
Fe3+/Fe2+ |
Ag+/Ag |
Au3+/Au |
(V) |
-2,356 |
0 |
0,771 |
0,799 |
1,52 |
Cho các thí nghiệm sau:
(1) Cho 10 mL dung dịch Fe(NO3)2 2M vào 10 mL dung dịch AgNO3 2M.
(2) Cho vàng (Au) vào dung dịch HCl 1M.
(3) Cho bột magnesium vào dung dịch Fe(NO3)3.
(4) Cho bột magnesium vào dung dịch H2SO4 0,5M.
(5) Cho 10 mL dung dịch MgCl2 2M vào 10 mL dung dịch FeCl2 2M.
Số thí nghiệm có xảy ra phản ứng hóa học ở 25oC là
A. 5.
B. 2.
C. 3.
D. 4.
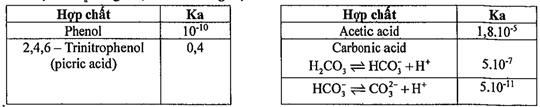
Câu 13. Hằng số acid Ka trong nước ở 25oC của một số hợp chất được cho trong bảng sau đây
Cho các phát biểu sau:
(1) Ở điều kiện thường, acetic acid và phenol đều ít tan trong nước.
(2) Dung dịch picric acid không làm đổi màu quỳ tím.
(3) Dung dịch picric acid phản ứng với dung dịch sodium carbonate không sinh ra khí.
(4) Sục khí CO2 vào dung dịch sodium phenolate trong suốt thấy dung dịch bị vẩn đục.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14. Ở điều kiện thường, đơn chất G1 là chất khí có màu vàng nhạt. Trong dung dịch, G1 phản ứng thuận nghịch với nước ở nhiệt độ thấp tạo nên hai acid G2 và G3, còn khi đun nóng tạo nên acid G2 và G4. Cho biết G3 và G4 đều chứa các nguyên tố hydrogen, G1 và oxygen với thành phần phần trăm theo khối lượng được cho trong bảng sau
Tổng số nguyên tử các nguyên tố trong phân tử G3 và G4 lần lượt là
A. 3 và 5.
B. 3 và 6.
C. 4 và 3.
D. 5 và 6.
Câu 15. Có năm dung dịch đựng trong năm lọ riêng biệt, mỗi dung dịch chỉ chứa một chất tan có nồng độ 0,1M, gồm: (NH4)2SO4, K2SO4, Ba(OH)2, Na2CO3, HCl được đánh số ngẫu nhiên từ (1) đến (5).Tiến hành thí nghiệm với các dung dịch trên cho kết quả như sau:
- Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
- Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
- Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Cho các phát biểu sau:
(1) Giá trị pH của dung dịch ở lọ (4) lớn hơn giá trị pH của dung dịch ở lọ (1).
(2) Nhỏ vài giọt vào dung dịch ở lọ (2) vào giấy quỳ tím, giấy quỳ tím chuyển sang màu xanh.
(3) Chất tan trong lọ (5) có trong dịch vị của dạ dày của người.
(4) Cho dung dịch BaCl2 vào dung dịch ở lọ (3), thấy xuất hiện kết tủa màu vàng.
(5) Các chất tan trong lọ (1) và lọ (3) có thể được sử dụng làm phân bón hoá học.
Số phát biểu đúng là
A. 2.
B. 3.
C. 1.
D. 4.
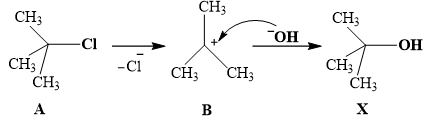
Câu 16. Phương trình hoá học của phản ứng thuỷ phân của dẫn xuất halogen để điều chế alcohol:
Cơ chế của phản ứng như sau:
Cho các nhận định sau:
(1) Chất X là alcohol bậc 3.
(2) Phản ứng trên thuộc loại phản ứng thế.
(3) Nguyên tử carbon có độ âm điện nhỏ hơn nguyên tử chlorine nên cặp electron của liên kết C – Cl bị lệch về phía nguyên chlorine.
(4) Tách nước hợp chất X thu được sản phẩm có đồng phân hình học cis-trans.
(5) Ở giai đoạn chuyển hóa từ B sang X có sự tạo thành liên kết mới do sự xen phủ các orbital s-p.
Số nhận định đúng là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 17. Kết quả phân tích nguyên tố của hợp chất amine đơn chức X có phần trăm khối lượng các nguyên tố như sau: %C = 65,75%; %H = 15,07%; %N = 19,18%. Từ chất X thực hiện sơ đồ chuyển hóa sau:
X Y Z kết tủa màu vàng
Cho các phát biểu sau:
(1) Ở điều kiện thường chất X là chất khí, có mùi xốc và tan tốt trong nước.
(2) Chất Y là alcohol bậc hai.
(3) Chất X là amine bậc một, có tên thay thế là 1-methylpropan-1-amine.
(4) Oxi hóa chất Z bằng NaBH4 thì thu được chất Y.
(5) Chất Z có chứa 2 nhóm methyl trong phân tử.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 18. Tinh bột là polysaccharide được tạo thành từ hai loại polimer: amylose (10-30%) và amylopectin (70-90%). Cả hai đều là polymer của α-glucose được liên kết bằng liên kết glycoside, nhưng khác nhau về cấu trúc:
- Amylose là chuỗi không phân nhánh với các đơn vị glucose liên kết α-1,4-glycoside, mỗi chuỗi thường chứa hơn 1000 đơn vị glucose. Trong dung dịch, chuỗi amylose xoắn lại thành cấu trúc xoắn ốc với 6 đơn vị glucose trong mỗi vòng xoắn, tạo ra một khoang trống bên trong. Khi có mặt iodine, phân tử I2 sẽ nằm vừa khít trong khoang này, tạo phức màu xanh tím đặc trưng.
- Amylopectin cũng có cấu trúc cơ bản với liên kết α-1,4-glycoside, nhưng cứ sau 20-25 đơn vị glucose lại có một nhánh bên được tạo ra bởi liên kết α-1,6-glycoside. Do cấu trúc phân nhánh này, amylopectin chỉ tạo phức màu nâu đỏ nhạt với iodine.
Một nhóm học sinh dựa vào thông tin trên đã đưa ra các nhận định sau:
(1) Phản ứng thủy phân hoàn toàn 1 phân tử amylose sẽ có thể tạo thành tới 1000 phân tử glucose, trong khi amylopectin sẽ tạo ra nhiều hơn do có thêm các nhánh.
(2) Phản ứng màu với iodine có độ nhạy khác nhau giữa amylose và amylopectin vì chỉ có cấu trúc xoắn của amylose mới tạo được khoang phù hợp để giữ chặt phân tử I2.
(3) Trong phân tử amilopectin, số liên kết α-1,4-glycoside luôn nhiều hơn số liên kết α-1,6-glycoside vì cứ 20-25 liên kết α-1,4 mới có một liên kết α-1,6-glycoside tạo thành.
(4) Một nhược điểm của phép thử tinh bột bằng iodine là nó không thể phân biệt được hỗn hợp amylose và amylopectin với amylose nguyên chất, vì đều cho màu xanh tím.
(5) Nếu thủy phân không hoàn toàn một mẫu tinh bột chứa cả amylose và amylopectin, sẽ thu được hỗn hợp gồm glucose và các đoạn oligosaccharide có độ dài khác nhau.
Số nhận định đúng là
A. 2.
B. 5.
C. 3.
D. 4.
Câu 19. Tại một khu vực có quy định hàm lượng tối đa của SO2 trong không khí là 125 μg/m3. Tiến hành phân tích mẫu khí tại đây theo các bước như sau:
+ Bước 1: dẫn 50 lít không khí đi qua dung dịch H2O2 0,3% trong ống Impinger (ống lấy mẫu khí, chứa khoảng 15 mL dung dịch hấp thu), điều chỉnh tốc độ khí phù hợp để đảm bảo SO2 trong không khí được hấp thu hoàn toàn. Hydrogen peoxide sẽ oxi hóa sulfur dioxide thành sulfuric acid theo phản ứng
H2O2 + SO2 → H2SO4.
+ Bước 2: dung dịch thu được saukhi hấp thu đem cho phản ứng hoàn toàn với 10 mL dung dịch Ba(ClO4)2 10-4M. Loại bỏ kết tủa barium sulfate sau phản ứng thì thu được 25 mL dung dịch X, ion Ba2+ còn dư được xác định bằng phương pháp trắc quang với thuốc thử Thorin, kết quả đo được nồng độ ion Ba2+ trong X là 3,53.10-5M.
Nhận xét đúng về hàm lượng của SO2 trong mẫu không khí trên là
A. lượng SO2 vượt quá giới hạn 20,32%.
B. lượng SO2 vẫn đạt ngưỡng an toàn.
C. lượng SO2 đạt giá trị giới hạn tối đa.
D. lượng SO2 vượt quá giới hạn 66,4%.
Câu 20. Cho số liệu về nhiệt độ sôi và độ tan trong nước của ba dẫn xuất hydrocarbon có cùng carbon như bảng sau:
Chất |
Nhiệt độ sôi (oC) |
Độ tan ở 25 oC (g/100 g nước) |
CH3CH2OH |
78,3 |
∞ |
CH3CHO |
20,2 |
∞ |
CH3–COOH |
117,9 |
∞ |
Phân tích số liệu ở bảng trên, một học sinh có các nhận định sau:
(1) Acetic acid có nhiệt độ sôi cao hơn ethanol do liên kết hydrogen giữa các phân tử acetic acid bền vững hơn so với liên kết hydrogen giữa các phân tử ethanol.
(2) Cả ba chất đều tan tốt trong nước do tạo được liên kết hydrogen với nước.
(3) Do acetaldehyde không có liên kết hydrogen giữa các phân tử nên có nhiệt độ sôi thấp hơn ethanol và acetic acid.
(4) Cả ba chất đều là chất lỏng ở điều kiện thường và tan vô hạn trong nước.
(5) Tổng số liên kết sigma trong ba phân tử dẫn xuất ở trên bằng 21.
Số nhận định không đúng là
A. 1.
B. 4.
C. 3.
D. 2.
PHẦN II. Trắc nghiệm đúng-sai (9 điểm). Thí sinh trả lời từ câu 1 đến câu 6. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
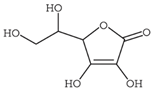
Câu 1. Ascorbic acid (hay vitamin C) được biết đến như một hợp chất quan trọng đối với con người. Nó đóng
vai trò chất chống lão hoá, tăng sức đề kháng của cơ thể.
Một nhóm học sinh được giao nhiệm vụ xác định hàm lượng ascorbic acid trong một viên uống cung cấp vitamin C. Nhóm học sinh đã biết được ngoài ascorbic acid (kí hiệu là H2As), các hoạt chất còn lại coi như không có phản ứng với NaOH. Phản ứng giữa ascorbic acid với NaOH được biểu diễn bởi phương trình hóa học sau:
H2As + NaOH → NaHAs + H2O
Điểm kết thúc chuẩn độ được xác định dựa vào chỉ thị phenol đỏ đã chuyển sang màu da cam (pH = 8,72). Nhóm học sinh tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy một viên vitamin C, đem cân được 800 mg.
Bước 2: Nghiền nhỏ, hoà tan vào nước, lọc bỏ phần không tan, thêm nước để được 100,0 mL (dung dịch X). Lấy 10 mL dung dịch X cho vào cốc sạch và nhỏ 1 - 2 giọt phenol đỏ vào, dung dịch thu được có màu đỏ.
Bước 3: Lấy dung dịch NaOH 0,02M cho vào burette đến vạch số 0. Mở khoá burette cho dung dịch NaOH từ từ vào cốc đựng dung dịch X (lắc nhẹ cốc trong quá trình thí nghiệm) cho đến khi dung dịch trong cốc có màu da cam và dừng lại. Ghi lại thể tích dung dịch NaOH đã dùng là V1 (mL). Lặp lại bước 3 thêm 2 lần nữa, kết quả thu được như sau:
a. Phân tử vitamin C có nhóm chức ketone.
b. Trong quá trình chuẩn độ, lúc đầu có thể mở khóa burette cho NaOH chảy nhanh, sau đó chậm dần, nhỏ từng giọt chậm rãi, lắc và quan sát. Để biết chuẩn độ nhanh tới khoảng bao nhiêu mL nên thử chuẩn độ nháp trước 1 lần (lần nháp này bỏ, chỉ lấy kết quả để áng chừng cho 3 lần sau).
c. Trong quá trình chuẩn độ, việc lắc nhẹ cốc giúp cho tốc độ phản ứng giữa ascorbic acid với NaOH diễn ra nhanh hơn.
d. Kết quả thí nghiệm của nhóm học sinh xác định được hàm hoạt chất ascorbic acid có trong viên uống là 65,2% (Kết quả được làm tròn đến hàng phần mười).
Câu 2. Muối copper(II) sulfate khan dễ hút ẩm tạo thành muối ngậm nước. Để xác định hàm lượng nước kết tinh trong muối CuSO4.nH2O (coi là không lẫn tạp chất) bằng phương pháp đun nóng, một nhóm học sinh thực hiện theo qui trình sau:
Khối lượng (gam) |
|
m1 |
30,1 |
m2 |
32,1 |
m3 sau lần nung thứ nhất |
31,8 |
m3 sau lần nung thứ hai |
31,5 |
m3 sau lần nung thứ ba |
31,38 |
m3 sau lần nung thứ tư |
31,38 |
m3 sau lần nung thứ năm |
31,38 |
Bước 1: Cân chén nung và ghi lại khối lượng vào bảng kết quả (m1)
Bước 2: Thêm một lượng khoảng 2 gam CuSO4.nH2O vào chén nung. Cân và ghi khối lượng mới của chén nung có chứa muối (m2).
Bước 3: Đặt chén nung có chứa CuSO4.nH2O lên lưới amiang và đun nóng khoảng 2 phút (nhiệt độ khoảng 150oC- 200oC).
Bước 4: Để nguội, sau đó cân lại chén nung cùng phần chất rắn còn lại bên trong và ghi lại khối lượng (m3).
Lặp lại bước 3 và bước 4 cho đến khi khối lượng cân được ở bước 4 không đổi. Kết quả của nhóm học sinh thu được ở bảng bên.
a. Sau khi khối lượng cân được ở bước 4 không đổi nếu để chất rắn ngoài không khí ẩm, khối lượng chất rắn sẽ không thay đổi.
b. Giả thuyết khoa học phù hợp với thí nghiệm trên là khi đun nóng, lượng nước kết tinh trong muối CuSO4.nH2O bay hơi, làm khối lượng chất rắn giảm.
c. Từ số liệu của thí nghiệm trên, nhóm học sinh xác định được phần trăm khối lượng nguyên tố kim loại trong tinh thể CuSO4.nH2O bằng khoảng 25% (kết quả được làm tròn đến hàng đơn vị).
d. Hòa tan muối CuSO4.nH2O vào nước thu được dung dịch có môi trường trung tính.
Câu 3. Phèn chua có công thức hóa học là K2SO4.Al2(SO4)3.24H2O thường được dùng để làm trong nước sinh hoạt. Thực hiện thí nghiệm làm giảm độ đục của nước, một học sinh tiến hảnh các bước sau:
Bước 1: Thu thập mẫu nước sông bị đục (có cặn bẩn lơ lửng).
Bước 2: Rót vào cốc (1) và cốc (2), mỗi cốc 200 mL mẫu nước trên. Cho tiếp một ít phèn chua vào cốc (1). Dùng đũa thủy tinh khuấy đều và để yên hai cốc khoảng 15 phút.
Bước 3: Đo pH của mẫu nước trong hai cốc.
Biết rằng nồng độ mol/lit ban đầu (C0) của ion Al3+ và pH của nước có mối liên hệ theo biểu thức dưới đây:
3C0 = 4,23 . 10-6 – [H+] + [OH-]
a. Phèn chua là chất điện li mạnh.
b. Sau bước 2, nước ở cốc (1) trong hơn nước ở cốc (2) là do khi tan trong nước, phèn chua phân li ra ion Al3+, ion này tham gia phản ứng thủy phân với nước tạo ra kết tủa dạng keo Al(OH)3 kéo theo các hạt bẩn lắng xuống theo.
c. Ở bước 3, pH đo được ở cốc (1) lớn hơn cốc (2).
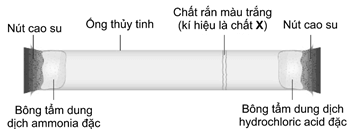
d. Để làm trong 3 m3 nước phục vụ sinh hoạt hằng ngày ở pH = 6,5 cần phải dùng hết tối thiểu 1870 gam phèn chua. (làm tròn kết quả đến hàng đơn vị).
Câu 4. Khuếch tán là sự dao động nhiệt của tất cả các phân tử. Sự khuếch tán dẫn đến sự dịch chuyển các phân tử từ một khu vực có nồng độ cao hơn đến khu vực có nồng độ thấp hơn. Một nhóm học sinh dự đoán “phân tử khối càng lớn, tốc độ khuếch tán càng cao”. Từ đó, học sinh tiến hành thí nghiệm như sau: cho hai miếng bông tẩm dung dịch ammonia đặc và dung dịch hydrochloric acid đặc đặt ở hai đầu ống thủy tinh. Đậy chặt miệng ống thủy tinh bằng nút cao su. Sau một thời gian thấy xuất hiện chất rắn màu trắng dạng đám khói. Sơ đồ thiết bị thí nghiệm và kết quả thí nghiệm được mô tả như hình vẽ dưới đây:
a. Phân tử khối của khí ammonia lớn hơn so với khí hydrogen chloride.
b. Thí nghiệm cho thấy tốc độ khuếch tán của khí ammonia chậm hơn so với khí hydrogen chloride.
c. Chất rắn X tan tốt trong nước tạo thành dung dịch có môi trường base.
d. Liên kết trong hợp chất X gồm liên kết cộng hóa trị kiểu góp chung electron, liên kết cộng hóa trị kiểu cho – nhận và liên kết ion.
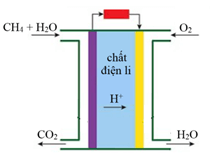
Câu 5. Pin nhiên liệu methane – oxygen hoạt động ở 80oC có cấu tạo và sơ đồ vận chuyển của nguyên liệu, sản phẩm như hình bên. Chất điện li là acid và các bán phản ứng xảy ra như sau:
(1) CH4(g) + 2H2O(g) → CO2(g) + 8H+(aq) + 8e
(2) O2(g) + 4H+(aq) + 4e → 2H2O(g)
Pin nhiên liệu hoạt động liên tục và do đó nguyên liệu liên tục được nạp vào và sản phẩm được chuyển ra khỏi hai điện cực.
a) Bán phản ứng (1) xảy ra tại cathode và bán phản ứng (2) xảy ra tại anode.
b) Trong cùng một khoảng thời gian, số mol khí đi vào cathode lớn hơn số mol khí đi vào anode.
c) Trong cùng một khoảng thời gian, số mol chất đi ra khỏi cathode nhỏ hơn số mol chất đi ra khỏi anode.
d) Trong quá trình pin hoạt động, ion H+ di chuyển từ anode đến cathode để trung hòa điện tích sinh ra do chuyển động electron và duy trì dòng điện ổn định ở mạch ngoài.
Câu 6. Chlorine hóa PVC thu được CPVC, một polimer chịu nhiệt, chịu hóa chất, chống nứt và có độ bền cơ học tốt hơn PVC. Giả thiết cứ 3 mắt xích C2H3Cl trong PVC tác dụng được với 2 phân tử Cl2 tạo thành đoạn mạch CPVC theo sơ đồ sau:
CPVC thu được có công thức (C6H5Cl7)n. Do cứ 3 mắt xích C2H3Cl tác dụng được với 2 phân tử Cl2 nên trung bình cứ 1,5 mắt xích C2H3Cl tác dụng được với 1 phân tử Cl2. Một nhà máy sản xuất loại nhựa CPVC có công thức (C16H19Cl13)n.
a. Phản ứng thế chlorine nhất thiết phải xảy ra ở tất cả các mắt xích C2H3Cl của PVC.
b. CPVC và PVC khi cháy đều sinh ra khói có chứa hydrogen chloride.
c. Trung bình cứ 1,6 mắt xích C2H3Cl trong PVC tác dụng được với 1 phân tử Cl2 tạo thành CPVC có công thức (C16H19Cl13)n.
d. Từ 10 tấn PVC, với hiệu suất toàn bộ quá trình là 80%, nhà máy thu được tối đa 11,5 tấn CPVC nêu trên.
PHẦN III. Câu trắc nghiệm trả lời ngắn (3 điểm). Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Baking soda (NaHCO3) là phụ gia thực phẩm, được dùng làm tăng độ xốp của bánh do dễ bị phân hủy tạo ra khí carbon dioxide và hơi nước, tạo nhiều lỗ xốp. Khi làm bánh, một đầu bếp đã sử dụng 3,36 gam banking soda để tăng độ xốp. Bánh được nướng ở nhiệt độ 160oC. Giả thiết có 10% tổng lượng khí và hơi nước tạo ra ở lại bánh, tạo thành các lỗ xốp. Biết ở điều kiện nhiệt độ, áp suất trên thì 1,0 mol khí có thể tích 35,5 lít. Tổng thể tích lỗ xốp tạo ra từ 3,36 gam banking soda trong điều kiện trên là bao nhiêu ml?
Câu 2. Độ tan trong nước của oxalic acid (H2C2O4) ở 60oC là 64 gam/100 gam nước; ở 10oC là 5,72 gam/100 gam nước. Khối lượng oxalic acid kết tinh dưới dạng H2C2O4.2H2O kết tinh từ 164 gam dung dịch bão hòa oxalic acid khi hạ nhiệt độ từ 60oC về 10oC là a gam. Giá trị của a bằng bao nhiêu? (kết quả làm tròn đến hàng phần mười).
Câu 3. Oxygen có vai trò rất quan trọng trong quá trình hô hấp của các vi sinh vật. Lượng oxygen hòa tan trong nước thường được xác định bằng phương pháp Winkler. Các phản ứng hóa học (chưa được cân bằng) xảy ra trong phương pháp Winkler như sau:
(1) Mn2+ + O2 + OH- → MnO(OH)2
(2) MnO(OH)2 + H+ + I- → Mn2+ + I2 + H2O
(3) I2 + S2O32- → I- + S4O62-
Khi phân tích 5 lít nước thì cần dùng vừa đủ dung dịch chứa 10 ml dung dịch Na2S2O32- 0,4M. Tính hàm lượng O2 trong mẫu nước trên theo đơn vị mg/lít.
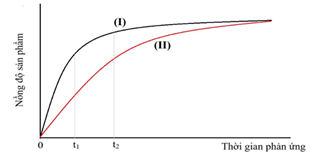
Câu 4. Enzyme là một chất xúc tác có bản chất protein và làm tăng tốc độ phản ứng. Đồ thị sau biểu diễn mối liên hệ giữa nồng độ chất sản phẩm của phản ứng khi có xúc tác và không có xúc tác enzyme.
Cho các nhận định sau:
(1) Đường (I) ứng với tốc độ phản ứng có xúc tác, đường (II) biểu diễn tốc độ phản ứng không có xúc tác.
(2) Trong khoảng thời gian từ 0 đến t1, tốc độ trung bình của phản ứng có xúc tác lớn hơn của phản ứng không có xúc tác.
(3) Trong khoảng thời gian từ t1 đến t2, tốc độ trung bình của phản ứng không có xúc tác lớn hơn của phản ứng có xúc tác.
(4) Khi phản ứng kết thúc, lượng sản phẩm thu được từ phản ứng có xúc tác lớn hơn lượng sản phẩm thu được từ phản ứng không có xúc tác.
Liệt kê các phát biểu đúng theo số thự tự tăng dần.
Câu 5. Cho dãy chuyển hóa sau:
Biết A8 là chất kết tủa; A1 là hợp chất của sulfur với 2 nguyên tố khác và có phân tử khối bằng 51 amu. Muối A1 này tồn tại ở dạng các tinh thể không màu, có thể hòa tan trong nước. Tổng giá trị phân tử khối của các chất từ A1 đến A8 bằng bao nhiêu?
Câu 6. Cho sơ đồ phản ứng sau:
Cho biết X1, X2 và X5 là các hợp chất hữu cơ chỉ chứa một loại nhóm chức. Trong chuyển hóa (b), X phản ứng với khí hydrogen (xúc tác Ni, đun nóng) thu được hỗn hợp sản phẩm trong đó có X3. Ở phản ứng (c), enzyme β-lipase chỉ xúc tác cho sự thủy phân nhóm ester liên kết với nguyên tử carbon số 2 của gốc glycerol. Cho các nhận xét sau đây:
(1) X1 là glycerol.
(2) Phân tử X2 có 17 nguyên tử carbon.
(3) Để tạo thành X3, 1 phân tử X cần phản ứng với 2 phân tử H2.
(4) X4 là hợp chất tạp chức.
(5) Thủy phân hoàn toàn 1 mol X4 bằng dung dịch NaOH dư thu được 1 mol X5.
Liệt kê các phát biểu đúng theo số thự tự tăng dần.
----------HẾT---------
Phòng Giáo dục và Đào tạo .....
Đề thi khảo sát Học sinh giỏi chương trình sách mới
năm 2024-2025
Bài thi môn: Hóa học 12
Thời gian làm bài: phút
(Đề số 1)
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
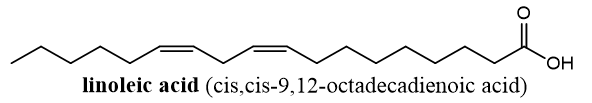
Câu 1: Linoleic acid (có cấu tạo như hình bên) là một trong những acid béo có lợi cho sức khỏe tim mạch, ngăn ngừa các bệnh về tim, động mạch vành.
Phát biểu nào sau đây sai?
A. Công thức của chất béo trilinolein là (C17H31COO)3C3H5.
B. Linoleic acid thuộc loại omega-6.
C. Trong phân tử linoleic acid có 2 liên kết pi.
D. Ở điều kiện thích hợp, 1 mol trilinolein tác dụng được tối đa với 6 mol H2.
Câu 2: Cho ba hợp chất hữu cơ có phân tử khối tương đương:
(1) C3H8;
(2) C2H5OH;
(3) CH3CHO.
Thứ tự giảm dần nhiệt độ sôi là
A. (2) > (3) > (1).
B. (1) > (2) > (3).
C. (3) > (2) > (1).
D. (2) > (1) > (3).
Câu 3: Phát biểu nào sau đây sai?
A. Trong quá trình chưng cất hỗn hợp C2H5OH và H2O thì chất bay hơi trước là C2H5OH.
B. Sự xen phủ trục giữa hai orbital sẽ tạo liên kết n.
C. Hợp chất ion thường tồn tại ở trạng thái rắn trong điều kiện thường.
D. Xen phủ bên giữa 2 orbital p tao ra liên kết n.
Câu 4: Phát biểu nào sau đây là sai?
A. Khi đốt củi, để tăng tốc độ cháy người ta xếp củi chặt khít và đốt củi trong lò kín.
B. Để muối dưa cải nhanh chua có thể dùng nước nóng muối dưa và thêm một ít nước dưa chua vào.
C. Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
D. Ướp đá thực phẩm sẽ giúp cho thực phẩm lâu bị hỏng hơn.
Câu 5: Hợp chất nào sau đây không phản ứng được với dung dịch NaOH?
A. p-CH3-C6H4-OH.
B. C6H5-CH2-OH.
C. CH3COOH.
D. HOOC-COOH.
Câu 6: Một số cơ sở sản xuất thuốc Bắc thường đốt một chất bột rắn X màu vàng (là một đơn chất) để tạo ra khí Y nhằm mục đích tẩy trắng, chống mốc. Tuy nhiên, theo các nhà khoa học thì khí Y có ảnh hưởng không tốt đến cơ quan nội tạng và khí Y cũng là một trong những nguyên nhân gây ra “mưa acid”. Chất rắn X là
A. phosphorus.
B. iodine.
C. sulfur.
D. carbon.
Câu 7: Phát biểu nào sau đây là sai ?
A. Điều kiện cần và đủ để xuất hiện đám cháy là nguồn nhiệt, chất cháy và chất oxi hóa.
B. Khi chữa cháy cần tuân theo quy tắc: Loại bỏ hoặc làm suy yếu bất kì yếu tố nào trong tam giác cháy (chất cháy, chất oxi hóa, nguồn nhiệt).
C. Các yếu tố đề hình thành “nổ bụi” gồm: Nguồn nhiệt, nồng độ bụi mịn đủ lớn, nguồn oxygen, nhiên liệu và không gian đủ kín.
D. Nước là chất có thể dùng để dập tắt mọi đám cháy.
Câu 8: Các biện pháp đề phòng cháy, nổ khi sử dụng bếp gas như sau:
a) Tập trung khi nấu nướng để tránh quên tắt thiết bị hoặc để các thiết bị quá nóng.
b) Khóa van cổ bình gas sau khi nấu xong.
c) Lựa chọn bình gas có xuất xứ rõ ràng.
d) Thường xuyên kiểm tra xem có rò rỉ khí gas hay không.
e) Không nên đặt bình gas vào hốc kín.
Số biện pháp đúng là
A. 3.
B. 5.
C. 4.
D. 2.
Câu 9: Mưa acid gây tác hại tới bầu khí quyển, phá huỷ môi trường sống của các loài sinh vật, làm hư hại các công trình kiến trúc,.... Mưa acid được tạo thành khi một số khí có trong không khí bị chuyển hoá thành các acid. Dãy gồm các khí nào sau đây đều có thể gây ra hiện tượng mưa acid?
A. SO2 và NO2.
B. CO và CO2.
C. CH4 và CO.
D. CH4 và SO2.
Câu 10: Cho các phát biểu sau:
a) Trong tự nhiên, phản ứng hóa hợp giữa nitrogen và oxygen thường xảy ra trong những cơn mưa dông kèm sấm sét.
b) Trong phân tử ammonium chloride (NH4Cl) có liên kết ion, liên kết cộng hóa trị.
c) Trong phân tử nitric acid HNO3, nguyên tử nitrogen có số oxi hóa +5.
d) Các phân tử NH3 có khả năng tạo liên kết hydrogen với phân tử nước.
Số phát biểu đúng là
A. 3.
B. 1.
C. 2.
D. 4.
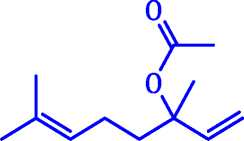
Câu 11: Linalyl acetate là một trong những của tinh dầu cam và mùi thơm của hoa oải hương. Cho công thức cấu tạo của linlalyl acetate được viết như sau:
Chọn phát biểu đúng:
A. Linalyl acetate là một carboxylic acid.
B. Linalyl acetate có 18 nguyên tử hydrogen.
C. Phân tử khối của Linalyl acetate là 196 amu.
D. Linalyl acetate có 2 đồng phân lập thể cis - trans.
Câu 12. Dẫn dòng khí gồm acetylene và ethylene lần lượt đi vào ống nghiệm (1) đựng dung dịch AgNO3/NH3 ở điều kiện thường, sau đó dẫn tiếp qua ống nghiệm (2) đựng nước bromine. Hiện tượng thí nghiệm nào sau đây là không đúng?
A. Ở ống nghiệm (1) có kết tủa màu vàng nhạt.
B. Ở ống nghiệm (2) màu của nước bromine nhạt dần.
C. Ở ống nghiệm (2) chất lỏng chia thành hai lớp.
D. Ở ống nghiệm (2) thu được chất lỏng đồng nhất.
PHẦN II (4,0 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Cho khoảng 3mL dung dịch saccharose 2% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều.
- Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
- Bước 3: Thêm từ từ NaHCO3 vào ống nghiệm sau bước 2 đến khi ngừng sủi bọt khí.
- Bước 4: Cho khoảng 2 mL dung dịch thu được sau bước 3 vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút.
a. Ở bước 3, thêm từ từ NaHCO3 vào để trung hòa lượng acid còn dư.
b. Ở bước 2, sản phẩm thủy phân saccharose chỉ thu được glucose.
c. Ở bước 4, hỗn hợp phản ứng chuyển dần từ màu xanh lam sang màu đỏ gạch.
d. Dung dịch thu được sau bước 3 gồm glucose và fructose do saccharose thủy phân tạo ra nên oxi hóa được thuốc thử Tollens để tạo thành kết tủa bạc kim loại.
Câu 2: Cho các thông tin các chất trong bảng sau:
|
Chất |
Benzyl chloride |
Benzyl alcohol |
o-Cresol |
|
Nhiệt độ sôi |
179 oC |
205,3 oC |
191 oC |
|
Nhiệt độ nóng chảy |
-39 oC |
-15,2 oC |
31 oC |
|
Nhiệt sinh chuẩn () |
|
-352 kJ mol-1 |
-204,3 kJ mol-1 |
|
Độ tan trong nước(20 oC) |
Rất ít tan (0,05%) |
3,50 gam/100mL |
<3,1 gam/100mL |
a. Benzyl chloride rất ít tan do không tạo được liên kết hydrogen với nước.
b. Ở điều kiện thường (25 oC), cả 3 chất trên tồn tại trạng thái lỏng.
c. Nhiệt độ sôi của benzyl alcohol lớn hơn nhiệt độ sôi của benzyl chloride là do benzyl alcohol có liên kết hydrogen giữa các phân tử.
d. Khi đốt cháy benzyl alcohol và o-Cresol đều cần lượng oxygen như nhau và phát sinh lượng nhiệt bằng nhau.
Câu 3: Cho phản ứng tổng hợp NH3 trong công nghiệp như sau: N2 + 3H2 2NH3 ArH°98 = -92,22 kJ Ban đầu nạp hai khí N2 (1 mol), H2 (4 mol) vào một bình kín thể tích 2 lít. Ở nhiệt độ 4270C, tại thời điểm cân bằng tỷ lệ áp suất hỗn hợp sản phẩm so với ban đầu là 0,928.
a. Cân bằng sẽ chuyển dịch theo chiều thuận tăng nhiệt độ và chất xúc tác Fe.
b. Phản ứng trên theo chiều thuận là phản ứng tỏa nhiệt.
c. Cho một lượng He vào bình phản ứng để áp suất khí trong bình tăng gấp đôi thì cân bằng chuyển dịch chiều thuận.
d. Hằng số cân bằng nồng độ của phản ứng trên ở nhiệt độ 4270C là 0,01526.
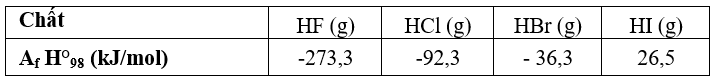
Câu 4: Biến thiên enthalpy tạo thành chuẩn của các halogen halide được cho trong bảng sau:
a. Năng lượng liên kết HX tăng dần từ HF đến HI.
b. Phản ứng tổng hợp HCl: H2(g) + Cl2(g) → 2HCl (g) có = -92,3 kJ.
c. Phản ứng tổng hợp HBr: H2(g) + Br2(g) → 2HBr (g) là phản ứng tỏa nhiệt.
d. Phản ứng phân hủy HI: 2HI(g) → H2(g) + I2 (g) là phản ứng thu nhiệt.
PHẦN III (1,0 điểm). Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 2.
Câu 1. Ở Nghệ An, vùng đất xã Giai Xuân, Tân Kỳ là vùng trồng mía nguyên liệu với năng suất khá cao. Ở đây, khi trồng mía, ngoài vôi và phân chuồng, người nông dân còn bón cả phân hoá học cho đất. Để đạt năng suất từ 130 - 140 tấn/1ha ở mỗi vụ mía tơ, họ cần bón cho mỗi hecta đất 230,4 kg nitrogen, 39,7848 kg phosphorus; 179,234 kg potassium. Giả sử loại phân hoá học mà người nông dân sử dụng là urea (độ dinh dưỡng 46%); phân lân nung chảy (90% Ca3(PO4)2) và phân NPK (loại 15-5-27). Các tạp chất còn lại không chứa các nguyên tố N, P, K. Tổng khối lượng phân bón ở trên đã sử dụng cho 3 ha đất là bao nhiêu kg?
Câu 2. Hợp chất X (chứa C, H, O; Mx = 180) có tác dụng hạ sốt, giảm đau. Phân tích thành phần phân tử X cho kết quả về phần trăm khối lượng các nguyên tố carbon và hydrogen lần lượt là 60,00% và 4,44%. Biết: X có chứa vòng benzene; Số liên kết pi (n) trong phân tử chất X là bao nhiêu?
B - TỰ LUẬN (12 điểm)
Câu I. (3,0 điểm).
1. Viết công thức Lewis, công thức cấu tạo của H2S, CO2 (cho biết S có Z=16; H có Z=1; O có Z=8; C có Z=6).
2. Tiến hành thí nghiệm phân huỷ NO2 ở 300 oC theo phương trình: 2NƠ2(g) ® 2NO(g) + O2 (g)
Kết quả thí nghiệm được biểu diễn ở bảng sau:
|
Thời gian (s) |
0 |
150 |
200 |
250 |
|
Nồng độ (mol/L) NO2 |
0,012 |
0,0056 |
0,0049 |
0,0045 |
a) Tính tốc độ trung bình của phản ứng theo độ giảm nồng độ của NO2 trong 150 giây đầu tiên.
b) Nhận xét về tốc độ trung bình của phản ứng theo thời gian.
3. Các nitrogen oxide là những chất gây ô nhiễm môi trường nên thế giới đang nỗ lực để giữ mức phát thải của chúng ở mức thấp bằng cách loại bỏ chúng khỏi dòng khí thải của quá trình đốt cháy. Một phương pháp cho mục đích này là kĩ thuật khử hoá xúc tác chọn lọc (SCR, selective catalytic reduction), trong đó nitrogen monoxide sẽ phản ứng với ammonia ở nhiệt độ cao để tạo thành khí nitrogen. Viết phương trình hóa học của phản ứng trên.
Câu II. (3,0 điểm).
1. Một người dân đã tiến hành sản xuất NaCl (muối ăn) theo quy trình sau: Lấy 3m3 nước biển có nồng độ NaCl là 3,5%, khối lượng riêng là 1,02 g/mL chảy qua 1 tấn cát mặn chứa 5% NaCl. Giả thiết rằng 75% NaCl trong cát mặn sẽ bị hòa tan vào nước biển để tạo thành nước chạt. Lấy toàn bộ nước chạt thu được đem lên ô kết tinh để phơi, biết có 3,8% nước chạt bị hao hụt, hiệu suất kết tinh NaCl từ nước chạt đạt 84%. Tính số kg NaCl mà người dân đó sản xuất thu được.
2. Hãy mô tả ngắn gọn đặc điểm của ao, hồ có hiện tượng phú dưỡng (do thừa nhiều nguyên tố dinh dưỡng như nitrogen, phosphorus).
3. Một trong những giải pháp giảm lượng khí SO2 thải vào bầu khí quyển gây ô nhiễm đó là người ta dùng vôi sống (thành phần chính CaO), vôi tôi ( thành phần chính Ca(OH)2) hoặc đá vôi nghiền ( thành phần chính CaCO3) để chuyển hóa SO2 thành các chất ít ô nhiễm. Em hãy viết các phương trình hóa học minh họa.
Câu III. (3,5 điểm).
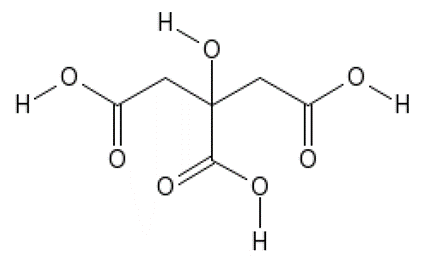
1. Chanh là một loài thực vật cho quả nhỏ, thuộc chi Cam chanh (Citrus), khi chín có màu xanh hoặc vàng, thịt quả có vị chua. Quả chanh được sử dụng làm thực phẩm trên khắp thế giới - chủ yếu dùng nước ép của nó, thế nhưng phần cơm (các múi của chanh) và vỏ cũng được sử dụng, chủ yếu là trong nấu ăn và nướng bánh. Nước ép chanh chứa khoảng 5% (khoảng 0,3 mol/lít) citric acid, điều này giúp chanh có vị chua, và độ pH của chanh từ 2-3. Citric acid có công thức cấu tạo là:
a) Cho biết công thức phân tử của citric acid.
b) Viết các phương trình hóa học xảy ra khi cho citric acid lần lượt phản ứng với kim loai Na dư; dung dịch
NaOH dư.
2. Hợp chất hữu cơ X có công thức phân tử C3H6O. Chất X không có phản ứng với thuốc thử Tollens nhưng có phản ứng tạo iodoform. Xác định công thức cấu tạo X và viết phương trình hóa học của phản ứng xảy ra.
3. Cho các chất CH3COOH, CH3CH2OH, HCOOCH3. Hãy sắp xếp các chất trên theo chiều nhiệt độ sôi tăng dần. Giải thích.
4. Quá trình chuyền hóa sau xảy ra trong một nhà máy sản xuất phân đạm như sau:
S X Y Z H2SO4 NH4)2SO4.
a) Xác định X, Y, Z và hoàn thành các phương trình hóa học theo sơ đồ chuyển hóa trên.
b) Từ 40 tấn quặng chứa 80% S (phần tạp chất không chứa nguyên tố S) thì sản xuất được tối đa bao nhiêu tấn) (NH4)2SO4 theo quy trình trên ( biết hiệu suất cua cả quá trình sản xuất đạt 90%).
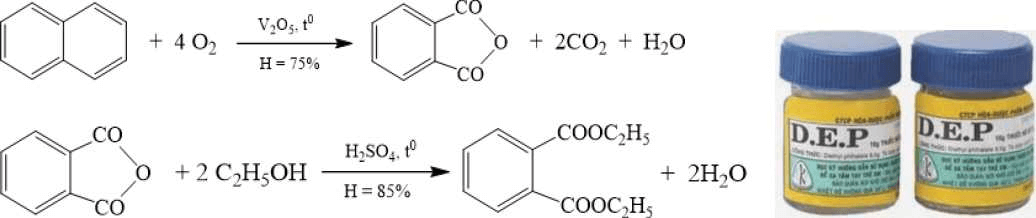
Câu V. (1,5 điểm).
Thuốc chữa ghẻ DEP được điều chế từ nguồn nguyên liệu đầu là naphthalene theo sơ đồ các quá trình chuyển hoá và hiệu suất sau:
DEP
a) Cho biết DEP thuộc loại hợp chất gì?
b) Tính khối lượng naphthalene và ethanol cần thiết để điều chế 1 tấn DEP.
------HẾT------
Thí sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học, cán bộ xem thi không phải giải thích gì thêm
Phòng Giáo dục và Đào tạo .....
Đề thi khảo sát Học sinh giỏi
năm 2024-2025
Bài thi môn: Hóa học 12
Thời gian làm bài: phút
Bài I: (4,0 điểm)
Viết các phương trình hóa học của phản ứng minh họa cho các thí nghiệm sau:
1. Cho hỗn hợp bột Cu và Fe2O3 vào dung dịch H2SO4 đậm đặc rồi đun nóng, dẫn khí sinh ra từ từ qua dung dịch Na2CO3 dư.
2. Đốt P trong bình đựng khí Cl2 rồi cho sản phẩm thu được vào nước.
Bài II: (4,0 điểm)
Bằng phương pháp hóa học, hãy nhận biết sự có mặt của từng hóa chất sau trong 4 lọ dung dịch mất nhãn: NaNO3, NaHSO4, ZnSO4 và Al2(SO4)3.
Bài III: (3,0 điểm)
1. Hòa tan hoàn toàn hỗn hợp (X) có khối lượng 6,54 gam gồm Al2O3 và hai oxit của Fe bằng dung dịch H2SO4 loãng (vừa đủ) được dung dịch (Y). Cho (Y) tác dụng với dung dịch NaOH dư, lọc kết tủa nung trong không khí đến khối lượng không đổi thu được 3,60 gam chất rắn. Biết rằng oxigen chiếm 36,6973% tổng khối lượng (X). Xác định công thức các oxit của Fe và tính khối lượng từng oxit trong (X).
2. Trộn 40 gam dung dịch (D) với dung dịch CuSO4, lọc kết tủa, làm khô thì thu được 2,54 gam chất rắn và dung dịch còn lại chỉ chứa 0,01 mol Na2SO4. Xác định thành phần và tính nồng độ phần trăm của muối trong dung dịch (D).
Bài IV: (5,0 điểm)
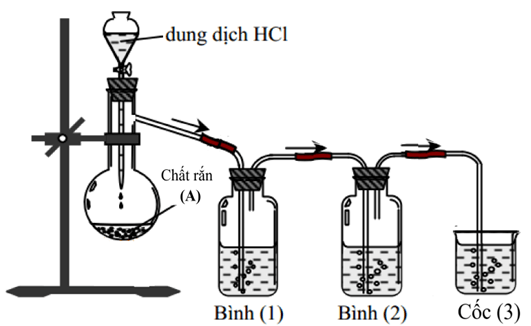
|
1. Hình bên mô tả thí nghiệm điều chế và thử tính chất hóa học của một hiđrocacbon (R). Hãy đề nghị Chất rắn (A), các dung dịch hóa chất thích hợp trong Bình (1), Bình (2), Cốc (3) và viết tất cả phương trình hóa học của các phản ứng xảy ra trong thí nghiệm. Biết rằng khi tiến hành thí nghiệm thì tại Bình (1) và Cốc (3) có xuất hiện kết tủa. 2. Đốt cháy hoàn toàn m gam (R) rồi dẫn toàn bộ sản phẩm cháy thu được vào bình chứa sẵn 500 ml dung dịch Ca(OH)2 0,2 M. Sau thí nghiệm thấy khối lượng dung dịch giảm 1,54 gam so với ban đầu. Tính giá trị m? |
Bài V: (4,0 điểm)
Hòa tan hỗn hợp (E) thu được từ thí nghiệm nung bột Al và S bằng dung dịch HCl lấy dư thấy còn lại 0.04 gam chất rắn và có 1,344 lít khí bay ra (ở điều kiện tiêu chuẩn). Cho toàn bộ khí đó đi qua dung dịch CuSO4 lấy dư, sau phản ứng thu được 2,88 gam kết tủa.
1. Xác định thành phần phần trăm của Al và S trước khi nung.
2. Hòa tan hoàn toàn hỗn hợp (E) như trên bằng dung dịch HNO3 đặc nóng (cho sản phẩm khử duy nhất) thì thu được V lít khí (đo ở điều kiện tiêu chuẩn) có tỉ khối hơi so với H2 bằng 24. Tính giá trị V.
Cho khối lượng nguyên tử gần đúng của các nguyên tố:
H=1; Be=9; C=12; N=14; O=16; Na=23; Al=27; S=32; Ca=40;
Fe=56; Cu=64; Zn=65; Sn=119; Pb=207.
-------------------HẾT-----------------------
HƯỚNG DẪN GIẢI
Bài I: (4,0 điểm)
|
TÓM TẮT CÁCH GIẢI |
ĐIỂM |
|
|
1 |
Cu + 2H2SO4 CuSO4 + SO2 + 2H2O Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O SO2 + Na2CO3 + H2O → NaHCO3 + NaHSO3 SO2 + Na2CO3 → Na2SO3 + CO2 |
2.00 |
|
2 |
2P + 3Cl2 2PCl3 2P + 5Cl2 2PCl5 PCl3 + 3H2O → 3HCl + H3PO3 PCl5 + 4H2O → 5HCl + H3PO4 |
2.00 |
Bài II: (4,0 điểm)
|
TÓM TẮT CÁCH GIẢI |
ĐIỂM |
|
- Dùng Cu và HCl nhận ra NaNO3. Hiện tượng: hòa tan bột Cu sinh ra khí không màu hóa nâu trong không khí 2NaNO3 + 8HCl + 3Cu → 3CuCl2 + 2NO + 2NaCl + 4H2O 2NO + O2 → 2NO2 |
1.00 |
|
- Dùng Zn nhận biết NaHSO4. Hiện tượng: hòa tan Zn, sủi bọt khí Zn + 2NaHSO4→ ZnSO4 + Na2SO4+ H2 |
1.00 |
|
- Dùng dung dịch NH3 dư, nhận ra: + ZnSO4. Hiện tượng: phản ứng tạo kết tủa keo và bị hòa tan khi NH3 dư ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4 Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 + Al2(SO4)3. Hiện tượng: phản ứng tạo kết tủa keo và không bị hòa tan khi NH3 dư Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4 |
2.00 |
Bài III: (3,0 điểm)
|
TÓM TẮT CÁCH GIẢI |
ĐIỂM |
|
|
1 |
→ mAl(trong X) = 6,54 – 0,045.56 – 0,366973.6,54 ≈ 1,62 gam |
0.50 |
|
=> |
0.50 |
|
|
→ 2 oxit là FeO và Fe2O3 có cùng số mol |
0.50 |
|
|
0.50 |
||
|
2 |
Dung dịch (D) phải có tính kiềm để tạo kết tủa với Cu2+ → muối Na+ với hiđroxit lưỡng tính (muối của ion phức) m hiđroxit = 2,54 – 0,01.98 = 1,56 gam 2Nax[X(OH)4] + xCuSO4 → xCu(OH)2 + 2X(OH)4-x + xNa2SO4 C%dung dịch (D) = Trường hợp học sinh tính theo công thức muối NaAlO2 (4,1%) vẫn được tính tròn điểm. |
1.00 |
Bài IV: (5,0 điểm)
|
TÓM TẮT CÁCH GIẢI |
ĐIỂM |
|
|
1 |
Chất rắn (A): CaC2 Bình (1): dung dịch AgNO3/NH3 Bình (2): dung dịch Br2 Cốc (3): dung dịch KMnO4. |
1.00 |
|
CaC2 + 2HCl → CaCl2 + C2H2 Bình (1) : C2H2 + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3 Bình (2): C2H2 + 2Br2 → C2H2Br4 Cốc (3): 3C2H2 + 8KMnO4 → 3KOOC – COOK + 8MnO2↓ + 2KOH + 2H2O |
2.00 |
|
|
2 |
|
0.50 |
|
Trường hợp Ca(OH)2 dư Ca(OH)2 + CO2 → CaCO3 + H2O 2a 2a 2a 2a Dung dịch giảm: 100.2a – 44.2a – 18a = 1,54 → a ≈ 0,0164 mol m(R) ≈ 0,0164.26 = 0,426 gam |
0.75 |
|
|
Trường hợp Ca(OH)2 thiếu Ca(OH)2 + CO2 → CaCO3 + H2O 0,1 0,1 0,1 CaCO3 + CO2 + H2O → Ca(HCO3)2 2a-0,1 2a-0,1 Dung dịch giảm: 100.(0,2 – 2a) – 44.2a– 18a = 1,54 → a ≈ 0,0603 mol m(R) ≈ 0,0603.26 = 1,5678 gam |
0.75 |
|
Bài V: (4,0 điểm)
|
TÓM TẮT CÁCH GIẢI |
ĐIỂM |
|
|
1 |
2Al + 6HCl → 2AlCl3 + 3H2 Al2S3 + 6HCl → 2AlCl3 + 3H2S CuSO4 + H2S → CuS + H2SO4 |
1.50 |
|
mAl = (0,02 + 0,02).27 = 1,08 gam (51,92%) mS = 0,03.32 + 0,04 = 1,00 gam (48,08%) |
1.50 |
|
|
2 |
Mhỗn hợp khí = 48 → NO2 : SO2 = 8:1 Các quá trình oxi hóa – khử xảy ra: → x = 0,03075; y = 0,0005 V=22,4. (0,12 + 4.0,03075 + 6.0,0005 + 0,03075) = 6,1992 lít |
1.00 |
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Đề thi HSG Hóa 12 năm 2026 mới nhất, để mua tài liệu trả phí đầy đủ, Thầy/Cô vui lòng xem thử:
Xem thêm Đề thi học sinh giỏi lớp 12 các môn học khác:
- Đề thi học sinh giỏi Toán 12
- Đề thi học sinh giỏi Văn 12
- Đề thi học sinh giỏi Tiếng Anh 12
- Đề thi học sinh giỏi Sinh học 12
- Đề thi học sinh giỏi Địa Lí 12
- Đề thi học sinh giỏi Lịch Sử 12
- Tài liệu ôn thi học sinh giỏi Giáo dục KTPL 12
Xem thêm đề thi lớp 12 các môn học có đáp án hay khác:
Đề ôn thi Tốt nghiệp (các môn học), ĐGNL, ĐGTD các trường có đáp án hay khác:
Tài liệu giáo án lớp 12 các môn học chuẩn khác:
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

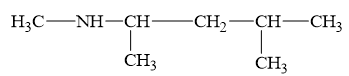


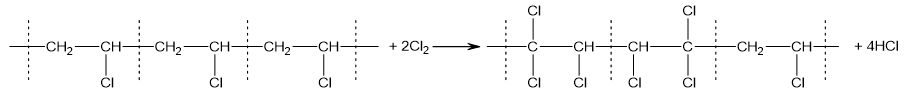
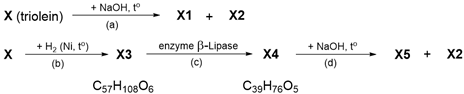
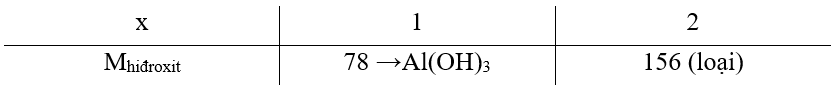
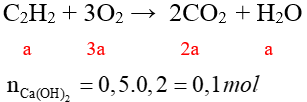
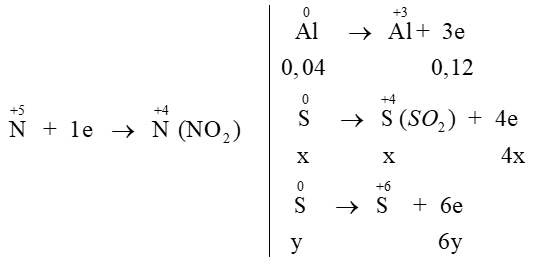






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

