Tóm tắt công thức Hóa học vô cơ lớp 10 chương trình mới (hay, chi tiết)
Với mục đích giúp học sinh dễ dàng hơn trong việc nhớ kiến thức & công thức môn Hóa học 10, VietJack biên soạn Tóm tắt công thức Hóa học vô cơ lớp 10 chương trình mới hay, chi tiết. Hi vọng loạt bài này sẽ như là cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa 10.
Tóm tắt công thức Hóa học vô cơ lớp 10 chương trình mới (hay, chi tiết)
(199k) Xem Khóa học Hóa 10 KNTTXem Khóa học Hóa 10 CDXem Khóa học Hóa 10 CTST
Công thức tính biến thiên enthalpy chuẩn theo năng lượng liên kết
Công thức tính biến thiên enthalpy theo nhiệt tạo thành chuẩn
Công thức tính tốc độ tức thời của phản ứng hay công thức định luật tác dụng khối lượng
Công thức Hóa học vô cơ lớp 10
Lưu trữ: Tóm tắt công thức Hóa học vô cơ lớp 10 (sách cũ)
- Tóm tắt công thức Hóa học lớp 10 Chương 1
- Tóm tắt công thức Hóa học lớp 10 Chương 2, 3, 4, 5
- Tóm tắt công thức Hóa học lớp 10 Chương 6
- Tóm tắt công thức Hóa học lớp 10 Chương 7
CHƯƠNG I: NGUYÊN TỬ
1. Công thức về thành phần nguyên tử
- Số hiệu nguyên tử (Z) = số đơn vị điện tích hạt nhân = số proton (P) = số electron (E);
Z = P = E
- Tổng các hạt trong nguyên tử = số proton + số electron + số nơtron = P + E + N
- Tổng các hạt trong hạt nhân nguyên tử = số proton + số nơtron = P + N
2. Đơn vị khối lượng nguyên tử
1u =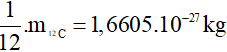
3. Số khối (A) = số proton + số nơtron = Z + N
4. Kí hiệu nguyên tử: 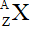
Trong đó:
X là kí hiệu hóa học
A là số khối (A = P + N)
Z là số hiệu nguyên tử (Z = P = E)
5. Tính nguyên tử khối trung bình
- Giả sử nguyên tố có hai đồng vị A và B
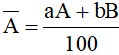
Trong đó:
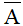 : là nguyên tử khối trung bình
: là nguyên tử khối trung bình
A, B lần lượt là nguyên tử khối của hai đồng vị A và B
a, b lần lượt là tỉ lệ % số nguyên tử của mỗi đồng vị A và B.
- Mở rộng, nguyên tố có n đồng vị
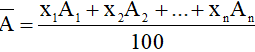
Trong đó:
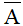 : là nguyên tử khối trung bình
: là nguyên tử khối trung bình
A1, A2 …An lần lượt là nguyên tử khối của các đồng vị;
x1; x2; … xn lần lượt là tỉ lệ % số nguyên tử của mỗi đồng vị.
6. Số electron tối đa trong một lớp = 2.n2
Với n là số thứ tự của lớp electron.
7. Trật tự phân mức năng lượng
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p …
8. Thể tích nguyên tử
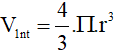
CHƯƠNG II: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
1. Vị trí nguyên tố trong bảng tuần hoàn
- STT ô = số hiệu nguyên tử = số proton = số electron.
- STT chu kì = số lớp electron.
- STT nhóm = số electron hóa trị.
2. Các công thức tạo bởi nguyên tố R, thuộc nhóm nA trong bảng tuần hoàn:
- Công thức oxit cao nhất:
+ R2On (với n =)
+ (với n = )
- Công thức hợp chất khí với hiđro: RH8- n
CHƯƠNG III. LIÊN KẾT HÓA HỌC
Hiệu độ âm điện và liên kết hóa học
Giả sử hợp chất có dạng AxBy
Hiệu độ âm điện: 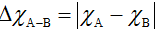
Nếu:
0 ≤ 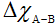 < 0,4: liên kết cộng hóa trị không cực
< 0,4: liên kết cộng hóa trị không cực
0,4 ≤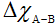 < 1,7: liên kết cộng hóa trị có cực
< 1,7: liên kết cộng hóa trị có cực
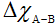 ≥ 1,7: liên kết ion
≥ 1,7: liên kết ion
CHƯƠNG IV: PHẢN ỨNG OXI HÓA KHỬ
Bảo toàn electron: ∑nenhường = ∑ne nhận
CHƯƠNG V: NHÓM HALOGEN
Tính khối lượng muối thu được khi cho kim loại phản ứng hết với HCl:
Tổng quát: mmuối = mKL + mgốc axit
m muối clorua = mhỗn hợp KL +71.nH2
CHƯƠNG VI: OXI – LƯU HUỲNH
1. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
m muốisunfat = m hỗn hợp KL + 96.nH2
2. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
m muối sunfat = mhỗn hợp KL + 80.nH2SO4
3. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
mmuối= mKL +96.nSO2
4. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:
mmuối= mKL + 96.(nSO2 + 3nS + 4nH2S)
5. Bài toán dẫn khí SO2 (hoặc H2S) vào dung dịch kiềm
Đặt T = 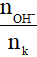
+ T ≥ 2: chỉ tạo muối trung hòa;
+ T ≤ 1: chỉ tạo muối axit;
+ 1 < T < 2: thu được cả muối trung hòa và muối axit.
Chú ý:
mbình tăng = mchất hấp thụ
Nếu sau phản ứng có kết tủa:
mdd tăng = mchất hấp thụ - mkết tủa
mdd giảm = mkết tủa – mchất hấp thụ
CHƯƠNG VII: TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HÓA HỌC
1. Tốc độ trung bình của phản ứng
Xét phản ứng: A → B
Ở thời điểm t1, nồng độ chất A là C1 (mol/l);
Ở thời điểm t2, nồng độ chất A là C2 (mol/l)
Tốc độ phản ứng tính theo chất A trong khoảng thời gian từ t1 đến t2 được xác định như sau:
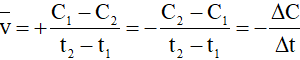
Nếu tốc độ được tính theo sản phẩm B thì
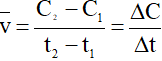
Trong đó:
Ở thời điểm t1, nồng độ chất B là (mol/l);
Ở thời điểm t2, nồng độ chất B là (mol/l).
2. Hằng số cân bằng trong hệ đồng thể
Một cách tổng quát nếu ta có phản ứng thuận nghịch sau:
aA + bB 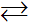 cC + dD
cC + dD
A, B, C, D là những chất khí hoặc những chất tan trong dung dịch.
Khi phản ứng ở trạng thái cân bằng, ta có:
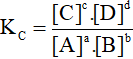
Xem thêm đề thi lớp 10 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 10 các môn học chuẩn khác:
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài 500 Công thức, Định Lí, Định nghĩa Toán, Vật Lí, Hóa học, Sinh học được biên soạn bám sát nội dung chương trình học các cấp.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

