Cl2 + Fe → FeCl3 | Cl2 ra FeCl3 | Fe ra FeCl3
Phản ứng Cl2 + Fe hay Cl2 ra FeCl3 hoặc Fe ra FeCl3 thuộc loại phản ứng hóa hợp, phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Cl2 có lời giải, mời các bạn đón xem:
3Cl2 + 2Fe 2FeCl3
Điều kiện phản ứng
Nhiệt độ > 250oC
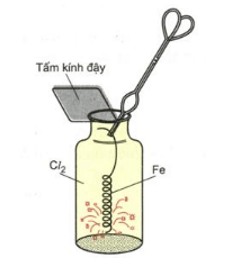
Cách thực hiện phản ứng
Cho dây sắt quấn hình lo xo đã được nung nóng đỏ vào bình đựng khí Cl2.
Hình 1. Sợi dây sắt nung đỏ cháy trong clo
Hiện tượng nhận biết phản ứng
Sắt cháy sáng tạo thành khói màu nâu đỏ (FeCl3).
Bạn có biết
Sắt phản ứng với clo tạo thành sắt(III) clorua, sắt phản ứng với dung dịch HCl tạo thành iron (II) chloride.
Fe + 2HCl → FeCl2 + H2↑
Ví dụ minh họa
Ví dụ 1: Hiện tượng xảy ra khi nung nóng dây sắt quấn lò xo vào bình chứa khí Clo là gì?
A. Sắt cháy tạo thành khói trắng dày đặc bám vào thành bình.
B. Không thấy hiện tượng phản ứng.
C. Sắt cháy sáng tạo thành khói màu nâu đỏ.
D. Sắt cháy sáng tạo thành khói màu đen.
Hướng dẫn giải
Đáp án đúng là: C
Hiện tượng: Sắt cháy sáng tạo thành khói màu nâu đỏ.
2Fe + 3Cl2 2FeCl3
Ví dụ 2: Cho 11,2 g bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 g muối sắt. Khối lượng khí clo tham gia phản ứng là:
A. 21,3 gam
B. 20,5 gam
C. 10,55 gam
D. 10,65 gam
Hướng dẫn giải
Đáp án đúng là: A
2Fe + 3Cl2 2FeCl3
Áp dụng định luật bảo toàn khối lượng ta có
= 32,5 -11,2= 21,3 gam
Ví dụ 3: Cho phản ứng sau: 2Fe + 3Cl2 2FeCl3. Cần bao nhiêu gam Fe phản ứng để tạo ra 0,2 mol FeCl3?
A. 8,1 gam.
B. 11,2 gam.
C. 12,7 gam.
D. 10,8 gam.
Hướng dẫn giải
Đáp án đúng là: B
⇒ mFe = 0,2.56 = 11,2 gam.
Xem thêm các phương trình hóa học hay khác:
- 2KClO3 + 3C 2KCl + 3CO2↑
- HClO + KOH → KClO + H2O
- NH3 (k) + HCl (k) → NH4Cl (r)
- 8NH3 + 3Cl2 → N2 + 6NH4Cl
- 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
- NH4Cl + AgNO3 → NH4NO3 +AgCl↓
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
- NH4Cl + NaOH → NaCl + NH3↑ + H2O
- 2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
- NH4Cl (r) NH3 (k) + HCl (k)
- 3HCl + Al(OH)3 → AlCl3 + 3H2O
- 2FeCl3 + Fe → 3FeCl2
- 2NaCl → 2Na + Cl2
- Cl2 + H2O ⇄ HCl + HClO
- HCl + KOH → KCl + H2O
- Cl2 + 2NaBr → 2NaCl + Br2
- 2NaCl + 2H2O → 2NaOH + Cl2 + H2
- Cl2 + 2NaOH → NaCl + NaClO + H2O
- 2KClO3 2KCl + 3O2↑
- 2Cl2 + 2Ca(OH)2 → Ca(OCl)2 + CaCl2 + 2H2O
- NaCl + H2SO4 → NaHSO4 +HCl
- 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
- HCl + NaHCO3 → NaCl + H2O + CO2↑
- 14HCl + K2Cr2O7 → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
- 6HCl + KClO3 → 3Cl2↑ + KCl + 3H2O
- 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
- HCl + NaAlO2 + H2O → NaCl + Al(OH)3↓
- 2HCl + CaOCl2 → CaCl2 + Cl2↑ + H2O
- 4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
- 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- 2CaOCl2 → 2CaCl2 + O2
- 2HCl + Fe → FeCl2 + H2↑
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



