Top 9 Đề thi Hóa học 12 Học kì 2 năm 2026 có đáp án
Top 9 Đề thi Hóa học 12 Học kì 2 năm 2026 có đáp án
Dưới đây là danh sách Top 9 Đề thi Hóa học 12 Học kì 2 năm 2026 có đáp án. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 2 Hóa học 12
Môn: Hóa học 12
Thời gian làm bài: 45 phút
Câu 1. Chất có tính chất lưỡng tính là
A. NaOH.
B. NaHCO3.
C. KNO3.
D. NaCl.
Câu 2. Nhóm các chất nào sau đều tác dụng với dd Fe(NO3)3 là
A. Fe, Cu, Ag.
B. Fe, Al, Cu.
C. Al, Ag, Mg.
D. Fe, Mg, Ag.
Câu 3. Trong đời sống, muối hiđrocacbonat X có nhiều ứng dụng trong thực tế, một trong những ứng dụng đó là sản xuất nước giải khát. Muối X đó là
A. NaHCO3.
B. KHCO3.
C. Ba(HCO3)2.
D. Mg(HCO3)2.
Câu 4. Các oxit sau: FeO, MgO, Fe3O4, ZnO những oxit nào phản ứng với HNO3 có tạo ra khí?
A. FeO, Fe3O4.
B. MgO, FeO.
C. Fe3O4, ZnO.
D. MgO, ZnO.
Câu 5. Oxit kim loại bị khử bởi CO ở nhiệt độ cao là
A. Al2O3.
B. K2O.
C. CuO.
D. MgO.
Câu 6: Nước có chứa nhiều các ion nào sau đây được gọi là nước cứng?
A. Ca2+, Mg2+.
B. Cu2+, Fe2+.
C. Zn2+, Al3+.
D. K+, Na+.
Câu 7: Kim loại nào sau đây khử được ion Fe2+trong dung dịch?
A. Fe.
B. Mg.
C. Na.
D. Cu.
Câu 8: Nhận xét nào sau đây không đúng?
A. Các kim loại kiềm đều mềm và nhẹ.
B. Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao.
C. Các kim loại kiềm đều có tính khử mạnh.
D. Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1.
Câu 9. Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp:
A. điện phân dung dịch.
B. điện phân nóng chảy.
C. thủy luyện.
D. nhiệt luyện.
Câu 10. Cho hỗn hợp gồm Na và Al tan vào nước thấy hỗn hợp tan hết. Nhận xét đúng là
A. Al tan hoàn toàn trong nước dư.
B. Số mol khí thoát ra bé hơn số mol Al và Na.
C. H2O dư và số mol Al lớn hơn số mol Na.
D. H2O dư và số mol Al bé hơn hoặc bằng số mol Na.
Câu 11. Khi nhiệt độ tăng độ dẫn điện của kim loại
A. Tăng.
B. Giảm.
C. Không đổi.
D. Không dẫn điện.
Câu 12. Cho các phát biểu sau:
a. Kim loại sắt có tính nhiễm từ.
b. Fe(OH)3 là chất rắn màu nâu đỏ.
c. CrO3 là một oxit axit.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. tất cả đều sai.
Câu 13. Ion M2+ có cấu hình electron ở lớp ngoài cùng là 3s23p6. Vị trí M trong bảng hệ thống tuần hoàn là
A. Ô 20, chu kì 4, nhóm IIA.
B. Ô 20, chu kì 4, nhóm IIB.
C. Ô 18, chu kì 3, nhóm VIIIA.
D. Ô 18, chu kì 3, nhóm VIIIB.
Câu 14. Tên của các quặng chứa FeCO3, Fe2O3, Fe3O4, FeS2 lần lượt là
A. hematit; pirit ; manhetit; xiđerit.
B. xiđerit; manhetit; pirit; hematit.
C. xiđerit; hematit; manhetit; pirit.
D. pirit; hematit; manhetit; xiderit.
Câu 15. Phát biểu nào dưới đây không đúng?
A. Crom có màu lục xám.
B. Crom là một kim loại cứng (chỉ kém hơn kim cương), cắt được thủy tinh.
C. Crom là kim loại khó nóng chảy (nhiệt độ nóng chảy là 1890°C).
D. Crom thuộc kim loại nặng (khối lượng riêng là 7,2 g/cm3).
Câu 16. Cấu hình electron nào dưới đây được viết đúng?
A. 26Fe: [Ar] 4s13d7.
B. 26Fe2+: [Ar] 4s23d4.
C. 26Fe2+: [Ar] 3d44s2 .
D. 26Fe3+: [Ar] 3d5.
Câu 17. Để nhận biết 2 chất rắn BaSO4 và AgCl, ta cho 2 chất
A. Tác dụng với dung dịch HCl.
B. Vào dung dịch quỳ tím.
C. Ra ngoài ánh sáng.
D. Tác dụng với dung dịch NaOH.
Câu 18. Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thuộc nhóm:
A. IA.
B. IIIA.
C. IVA.
D. IIA.
Câu 19.Chỉ dùng một thuốc thử nào trong số các thuốc thử cho dưới đây để nhận biết các khí SO2, O2, HCl ?
A. Giấy quỳ tím khô.
B. Giấy tẩm dung dịch phenolphtalein.
C. Que đóm còn than hồng.
D. Giấy quỳ tím ẩm.
Câu 20. Để khử hoàn toàn 8,0 gam bột Fe2O3 bằng bột Al (ở nhiệt độ cao, trong điều kiện không có không khí) thì khối lượng bột Al cần dùng là
A. 8,10 gam.
B. 1,35 gam.
C. 5,40 gam.
D. 2,70 gam.
Câu 21. Hòa tan hoàn toàn 2,7 gam Al bằng dung dịch HNO3 (loãng, dư), thu được V lit khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 1,12.
B. 2,24.
C. 4,48.
D. 3,36.
Câu 22: Trong các chất sau, chất nào có tính chất lưỡng tính ?
A. Cr2O3.
B. Al.
C. Fe2O3.
D. Cr.
Câu 23. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 57,4.
B. 28,7.
C. 10,8.
D. 68,2.
Câu 24. Cho 0,11 mol khí CO2 đi qua dung dịch NaOH sinh ra 11,44g hỗn hợp 2 muối. Số gam mỗi muối trong hỗn hợp là
A. 0,84 và 10,6.
B. 0.42 và 11,02.
C. 1,68 và 9,76.
D. 2,52 và 8,92.
Câu 25: Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Khối lượng muối tạo thành là
A. 8,18 g.
B. 6,5 g.
C. 10,07 g.
D. 8,35 g.
Đáp án & Thang điểm
Câu 1. B
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
Câu 2. B
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Al + Fe(NO3)3 → Al(NO3)3 + Fe
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2.
Câu 3. A
Câu 4. A
Trong FeO và Fe3O4 nguyên tố Fe chưa đạt số oxi hóa cao nhất. Do đó FeO và Fe3O4 phản ứng với HNO3 tạo ra khí.
Câu 5. C
CO khử được các oxit của kim loại đứng sau Al trong dãy hoạt động.
→ CO + CuO → Cu + CO2.
Câu 6. A
Câu 7. B
Mg + Fe2+ → Fe + Mg2+
Câu 8. B
Các kim loại kiềm có nhiệt độ nóng chảy thấp.
Câu 9. B
Câu 10. D
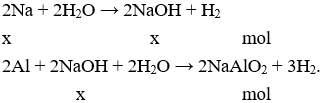
Vậy để Al tan hết thì H2O dư, số mol Al bé hơn hoặc bằng số mol Na.
Câu 11. B
Câu 12. C
Câu 13. A
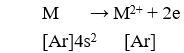
Vậy M ở ô 20 (z = 20), chu kỳ 4 (có 4 lớp e), nhóm IIA (2e hóa trị, nguyên tố s).
Câu 14. C
Câu 15. A
Crom có màu trắng ánh bạc.
Câu 16. D
Các cấu hình electron:
Fe (Z = 26): [Ar]3d64s2.
Fe2+: [Ar]3d6.
Fe3+: [Ar]3d5.
Câu 17. C
Khi ra ánh sáng AgCl bị phân hủy.
Câu 18. A
Kim loại kiềm thuộc nhóm IA.
Câu 19. D
Sử dụng quỳ tím ẩm:
+ Quỳ tím ẩm không đổi màu → O2.
+ Quỳ tím ẩm chuyển sang màu hồng → SO2.
+ Quỳ tím ẩm chuyển sang màu đỏ, sau đó mất màu → HCl.
Câu 20. D
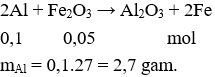
Câu 21. B
Bảo toàn electron có: 3.nAl = 3.nNO → nNO = 0,1 mol
VNO = 0,1.22,4 = 2,24 lít.
Câu 22. A
Câu 23. D
Gọi số mol FeCl2 là x (mol) → số mol NaCl là 2x (mol)
nhh = 24,4 (gam) → 127x + 117x = 24,4 → x = 0,1 (mol).
Cho AgNO3 vào dung dịch X có:
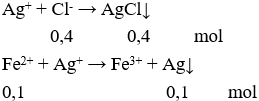
Khối lượng chất rắn là: m = 0,4.143,5 + 0,1.108 = 68,2 gam.
Câu 24. A
Theo bài ra hai muối thu được là NaHCO3 (x mol) và Na2CO3 ( y mol).
Bảo toàn C có: nkhí = x + y = 0,11 (1)
mmuối = 11,44 (g) → 84x + 106y = 11,44 (2)
Từ (1) và (2) có x = 0,01 và y = 0,1
Khối lượng NaHCO3 và Na2CO3 lần lượt là 0,84 gam và 10,6 gam.
Câu 25. A
Ta có mCu = 2,94 gam , mFe = 1,96 gam, nFe = 0,035 mol; nCu = 0,046 mol.
→ Sau phản ứng còn 2,3 gam < 2,94 gam → chất rắn không tan là Cu,dung dịch sau phản ứng chứa Cu(NO3)2 và Fe(NO3)2.
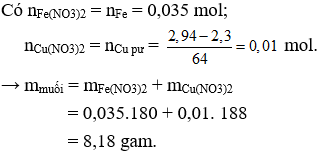
Sở Giáo dục và Đào tạo .....
Đề thi Học kì 2 Hóa học 12
Môn: Hóa học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Zn = 65, Fe = 56, Al = 27.
I. Phần trắc nghiệm
Câu 1: Trong các phản ứng sau phản ứng nào sai?
A. 3Fe + 2O2 → Fe3O4
B. Fe + CuSO4 dd → FeSO4 + Cu
C. Fe + 2HCldd → FeCl2 + H2
D. Fe + Cl2 → FeCl2
Câu 2: Kim loại nào sau đây phản ứng mạnh với nước ở nhiệt độ thường ?
A. Ca
B. Fe
C. Cu
D. Ag.
Câu 3: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 6,72 lít.
B. 11,2 lít.
C. 8,96 lít.
D. 17,92 lít.
Câu 4: Có 3 kim loại X, Y, Z thỏa mãn các tính chất sau:
- X tác dụng với dung dịch HCl, không tác dụng với dung dịch NaOH và dung dịch HNO3 đặc, nguội.
- Y tác dụng được với dung dịch HCl và dung dịch HNO3 đặc nguội, không tác dụng với dung dịch NaOH.
- Z tác dụng được với dung dịch HCl và dung dịch NaOH, không tác dụng với dung dịch HNO3 đặc nguội. X, Y, Z lần lượt có thể là
A. Fe, Mg, Zn.
B. Zn, Mg, Al.
C. Fe, Al, Mg.
D. Fe, Mg, Al.
Câu 5: Nhận định nào sau đây là đúng?
A. Cr là kim loại lưỡng tính.
B. Cr hoạt động hóa học mạnh hơn Zn và Fe.
C. Cr tác dụng với HNO3 đặc, nguội giải phóng NO2.
D. Cr bị thụ động hóa trong H2SO4 đặc, nguội.
Câu 6: Cho phản ứng hóa học sau: 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 2H2O. Trong phản ứng này FeO đóng vai trò là
A. chất oxi hóa.
B. vừa là chất khử, vừa là chất oxi hóa.
C. chất khử.
D. không là chất khử hay oxi hóa.
Câu 7: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Câu 8: Để đánh giá sự ô nhiễm kim loại nặng trong nước thải của một nhà máy, người ta lấy một ít nước, cô đặc rồi thêm dung dịch Na2S vào thấy xuất hiện kết tủa màu vàng. Hiện tượng trên chứng tỏ nước thải bị ô nhiễm bởi ion
A. Fe2+.
B. Cu2+.
C. Pb2+.
D. Cd2+.
Câu 9: Cho các hợp chất sau: Al2O3; Al(OH)3; MgO; FeO; Cr2O3; Cr(OH)3; CrO3; ZnO. Số hợp chất có tính lưỡng tính là
A. 5.
B. 6.
C. 7.
D. 8.
Câu 10: Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 0,746.
B. 0,448.
C. 1,792.
D. 0,672.
Câu 11: Để phân biệt các dung dịch hóa chất riêng biệt KOH, (NH4)2SO4, NH4Cl, K2SO4 có thể dùng hóa chất nào sau đây?
A. dd BaCl2.
B. dd AgNO3.
C. dd Ba(OH)2.
D. dd HCl.
Câu 12: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HBr.
(b) Cho Al2O3 vào dung dịch NaOH loãng, dư.
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho dung dịch Ba(OH)2 vào dung dịch NaHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là:
A. 3.
B. 2.
C. 1.
D. 4.
Câu 13: Cho dãy các chất: Cu, Fe3O4, NaHCO3 và Al(OH)3. Số chất trong dãy tác dụng được với dung dịch H2SO4 loãng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: Kim loại có những tính chất vật lý chung nào sau đây?
A. Tính dẻo, tính dẫn nhiệt, nhiệt độ nóng chảy cao.
B. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn, có ánh kim.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
D. Tính dẻo, có ánh kim, tính cứng.
Câu 15: Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 6,72.
D. 7,84.
II. Phần tự luận
Câu 1 (1,5 điểm): Viết các phương trình phản ứng xảy ra trong các thí nghiệm được mô tả sau:
a/ Hòa tan FeCl2 vào nước rồi thêm H2SO4 loãng dư, sau đó thêm dung dịch KMnO4 dư thấy có khí màu vàng lục thoát ra và dung dịch thu được có chứa muối mangan (II).
b/ Hòa tan Fe3O4 trong dung dịch H2SO4 đặc nóng dư được dung dịch A và khí B mùi hắc. Sục khí B vào dung dịch brom hoặc dung dịch KMnO4 đều thấy các dung dịch này bị nhạt màu.
Câu 2 (2 điểm): Hoà tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Tính giá trị của a.
Câu 3 (2 điểm): Cho một lượng bột Zn vào dung dịch X gồm FeCl2 và CuCl2. Khối lượng chất rắn sau khi các phản ứng xảy ra hoàn toàn nhỏ hơn khối lượng bột Zn ban đầu là 0,5 gam. Cô cạn phần dung dịch sau phản ứng thu được 13,6 gam muối khan. Tính khối lượng từng muối trong X.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | D | A | C | D | D | C | D | D | A | D | C | B | C | C | B |
Câu 1: 2Fe + 3Cl2 → 2FeCl3. Chọn đáp án D.
Câu 2: Ca phản ứng mạnh với nước ở nhiệt độ thường. Chọn đáp án A.
Câu 3: Bảo toàn khối lượng: mkhí = 40,3 – 11,9 = 28,4 gam → nkhí =0,4 mol.
→ Vkhí = 0,4.22,4 = 8,96 lít. Chọn đáp án C.
Câu 4:
- X tác dụng với dung dịch HCl, không tác dụng với dung dịch NaOH và dung dịch HNO3 đặc, nguội. X là Fe.
- Y tác dụng được với dung dịch HCl và dung dịch HNO3 đặc nguội, không tác dụng với dung dịch NaOH. Y là Mg.
- Z tác dụng được với dung dịch HCl và dung dịch NaOH, không tác dụng với dung dịch HNO3 đặc nguội. Z là Al.
Chọn đáp án D.
Câu 5: Nhận định đúng: Cr bị thụ động hóa trong H2SO4 đặc, nguội. Chọn đáp án D.
Câu 6: 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 2H2O. Số oxi hóa Fe tăng từ + 2 lên + 3.
FeO đóng vai trò là chất khử. Chọn đáp án C.
Câu 7: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí. Chọn đáp án D.
Câu 8: Cd2+ + S2- → CdS ↓ vàng. Chọn đáp án D.
Câu 9: Hợp chất có tính lưỡng tính là Al2O3; Al(OH)3; Cr2O3; Cr(OH)3; ZnO. Chọn đáp án A.
Câu 10:
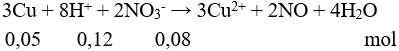
H+ hết → nNO = 0,12 : 4 = 0,03 mol → V = 0,672 lít. Chọn đáp án D.
Câu 11: Dùng Ba(OH)2, đun nóng
+/ Không hiện tượng → KOH
+/ Có khí không màu, mùi khai → NH4Cl
+ Có kết tủa trắng → K2SO4
+ Vừa có khí không màu, mùi khai, vừa có kết tủa trắng →(NH4)2SO4.
Câu 12:
(a) AgNO3 + HBr → AgBr ↓ + HNO3
(d) Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO3 + 2H2O. Chọn đáp án B.
Câu 13: Các chất: Fe3O4, NaHCO3 và Al(OH)3 tác dụng được với dung dịch H2SO4 loãng. Chọn đáp án C.
Câu 14: Kim loại có những tính chất vật lý chung: Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim. Chọn đáp án C.
Câu 15:
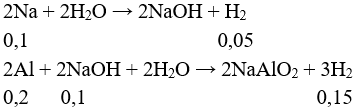
→ Vkhí = (0,05 + 0,15).22,4 = 4,48 lít. Chọn đáp án B.
2. Phần tự luận
Câu 1 (1,5 điểm):
a. Phương trình phản ứng:
10FeCl2 + 6KMnO4 + 24H2SO4 → 5Fe2(SO4)3 + 10Cl2 + 3K2SO4 + 6MnSO4 + 24H2O
b. 2Fe3O4 + 10H2SO4 (đặc nóng) → 3Fe2(SO4)3 + SO2 + 10H2O
Khí A là SO2:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4+ 2H2SO4
Câu 2 (2 điểm): Đặt số mol Al là x, số mol Al4C3 là y mol
→ x + y = 0,3 mol (1)
Kết tủa là Al(OH)3: 0,6 mol
Bảo toàn Al: x + 4y = 0,6 (2)
Giải hệ phương trình được: x = 0,2 và y = 0,1
Khí gồm H2 và CH4
Bảo toàn e: có 2.nH2 = 3.nAl → nH2 = 0,3 mol
Bảo toàn C: có nCH4 = 3.nAl4C3 = 0,3
a = 0,3 + 0,3 = 0,6 mol.
Câu 3 (2 điểm): Gọi số mol CuCl2 và FeCl2 lần lượt là x và y (mol)
PTHH:
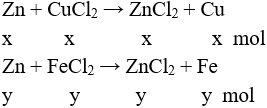
mCr↓ = 0,5 → 65 (x + y) – (64x + 56y) = 0,5
→ x + 9y = 0,5 (1)
Muối sau phản ứng là ZnCl2: 0,1 mol
→ x + y = 0,1 (2)
Giải hệ được: x = 0,05 và y = 0,05
mCuCl2 = 0,05.135 = 6,75g;
mFeCl2 = 0,05.127 = 6,35g.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Xem thêm các đề thi Hóa học 12 chọn lọc, có đáp án hay khác:
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 1)
- Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm có đáp án (Bài số 1)(8 đề)
- Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 1)(3 đề)
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 2)
- Top 8 Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm có đáp án (Bài số 2)(8 đề)
- Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 2)(3 đề)
- Top 9 Đề thi Hóa học 12 Giữa kì 2 năm 2026 (cấu trúc mới, có đáp án)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
- Top 9 Đề thi Hóa học 12 Giữa kì 2 năm 2026 (cấu trúc mới, có đáp án)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
Để học tốt lớp 12 các môn học sách mới:
- Giải bài tập Lớp 12 Kết nối tri thức
- Giải bài tập Lớp 12 Chân trời sáng tạo
- Giải bài tập Lớp 12 Cánh diều
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

