Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 1 - 3 đề)
Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 1 - 3 đề)
Dưới đây là danh sách Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 1 - 3 đề). Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
Trắc nghiệm + Tự luận
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 15 phút
(Đề 1)
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, C = 12, Ca = 40, Mg = 24, Ba = 137, Cu = 64.
I. Phần trắc nghiệm (3 điểm)
Câu 1: Kim loại nào sau đây được điều chế bằng phương pháp điện phân hợp chất nóng chảy?
A. Zn.
B. Fe.
C. K.
D. Cu.
Câu 2: Nguyên tử của kim loại kiềm có n lớp electron. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. ns2.
B. (n -1)dxnsy.
C. ns1.
D. ns2np1.
Câu 3: Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2.
B. Mg(HCO3)2, CaCl2.
C. CaSO4, MgCl2.
D. Ca(HCO3)2, MgCl2.
Câu 4: Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A. Ca(HCO3)2.
B. H2SO4.
C. FeCl3.
D. AlCl3.
Câu 5: Một mẫu khí thải có chứa CO2, NO2, N2 và SO2 được sục vào dung dịch Ca(OH)2 dư. Trong bốn khí đó, số khí bị hấp thụ là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 6: Xếp các kim loại kiềm thổ theo chiều tăng của điện tích hạt nhân thì
A. khả năng tác dụng với nước giảm dần.
B. tính khử giảm dần.
C. năng lượng ion hóa giảm dần.
D. bán kính nguyên tử giảm dần.
II. Phần tự luận (7 điểm)
Câu 1 (2 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Điện phân nóng chảy NaCl.
b/ NaHCO3 tác dụng với HCl.
c/ K tác dụng với H2O.
d/ CO2 tác dụng với Ca(OH)2 dư.
Câu 2 (3 điểm): Cho 1,37 gam Ba vào 1 lít dung dịch CuSO4 0,01 M. Sau khi các phản ứng xảy ra hoàn toàn, tính khối lượng kết tủa thu được.
Câu 3 (2 điểm): Nhiệt phân hoàn toàn 40 gam một loại quặng đôlômit có lẫn tạp chất trơ sinh ra 8,96 lít khí CO2 (ở đktc). Tính thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đ/a | C | C | A | A | D | C |
Câu 1: Những kim loại hoạt động mạnh như K, Na, Ca, Mg, Al được điều chế bằng phương pháp điện phân nóng chảy các hợp chất của kim loại. Chọn đáp án C.
Câu 2: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là ns1. Chọn đáp án C.
Câu 3:
Ca(HCO3)2 CaCO3 (↓) + CO2 + H2O
Mg(HCO3)2 MgCO3 (↓) + CO2 + H2O
Chọn đáp án A.
Câu 4:
OH- + HCO3- → CO32- + H2O
Ca2+ + CO32- → CaCO3 (↓ trắng)
Chọn đáp án A.
Câu 5: Có 3 khí trong dãy bị hấp thụ là CO2, SO2 và NO2. Chọn đáp án D.
Câu 6: Xếp các kim loại kiềm thổ theo chiều tăng của điện tích hạt nhân thì năng lượng ion hóa giảm dần. Chọn đáp án C.
2. Phần tự luận
Câu 1: (2 điểm) HS viết đúng mỗi PTHH 0,5 điểm, không cân bằng trừ ½ số điểm mỗi PTHH.
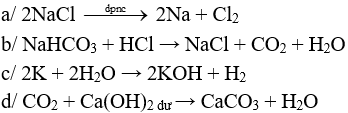
Câu 2: (3 điểm) Tính được: nBa = 0,01 mol, nCuSO4 = 0,01 mol.
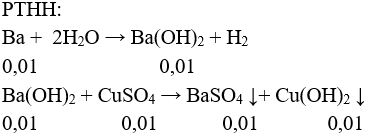
m↓ = mBaSO4 + mCu(OH)2 = 0,01.233 + 0,01.98 = 3,31 gam.
Câu 3: (3 điểm) Tính được số mol CO2 = 0,4 mol
Bảo toàn C có: nMgCO3.CaCO3 = 0,2 mol.
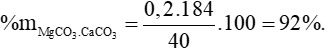
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 15 phút
(Đề 2)
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, Mg = 24, C = 12, Li = 7, Na = 23, K = 39, Rb = 85, Cs = 133, Ba = 137.
I. Phần trắc nghiệm (3 điểm)
Câu 1: Dãy gồm các kim loại được sản xuất trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là
A. Na, Ca, Al.
B. Na, Ca, Zn.
C. Na, Cu, Al.
D. Fe, Ca, Al.
Câu 2: Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, ở đktc). Khí X là
A. NO.
B. NO2.
C. N2O.
D. N2.
Câu 3: Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Vôi sống (CaO).
B. Thạch cao sống (CaSO4.2H2O).
C. Đá vôi (CaCO3).
D. Thạch cao nung (CaSO4.H2O).
Câu 4: Sản phẩm thu được khi điện phân dung dịch KCl (điện cực trơ, màng ngăn xốp) là
A. KOH, O2 và HCl.
B. KOH, H2 và Cl2.
C. K và Cl2.
D. K, H2 và Cl2.
Câu 5: Phát biểu nào sau đây là đúng?
A. Trong hợp chất, tất cả các kim loại kiềm đều có số oxi hóa +1.
B. Trong nhóm IA, tính khử của các kim loại giảm dần từ Li đến Cs.
C. Tất cả các hiđroxit của kim loại nhóm IIA đều dễ tan trong nước.
D. Tất cả các kim loại nhóm IIA đều có mạng tinh thể lập phương tâm khối.
Câu 6: Một cốc nước có chứa các ion: Na+ (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 mol), HCO3- (0,10 mol) và SO42- (0,01 mol). Đun sôi cốc nước trên cho đến khi các phản ứng xảy ra hoàn toàn thì nước còn lại trong cốc
A. là nước mềm.
B. có tính cứng vĩnh cửu.
C. có tính cứng toàn phần.
D. có tính cứng tạm thời.
II. Phần tự luận (7 điểm)
Câu 1 (2 điểm): Viết các PTHH xảy ra trong chuỗi phản ứng sau: NaCl → NaOH → NaHCO3 → Na2CO3 → NaCl.
Câu 2 (3 điểm): Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào dung dịch chứa 0,15 mol NaOH và 0,1 mol Ba(OH)2, thu được m gam kết tủa. Tính giá trị của m.
Câu 3 (2 điểm): Cho 8,5 gam hỗn hợp hai kim loại A, B thuộc hai chu kì liên tiếp ở nhóm IA vào nước thu được 3,36 lít khí H2. Xác định hai kim loại A và B.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đ/a | A | A | D | B | A | B |
Câu 1 (2điểm): Những kim loại hoạt động mạnh như Na, Ca, Al … được sản xuất trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng. Chọn đáp án A.
Câu 2: Áp dụng ĐL bảo toàn e: 0,15.2 = n.0,1 → n = 3. Vậy khí X là NO. Chọn đáp án A.
Câu 3: Thạch cao nung (CaSO4.H2O) được dùng để đúc tượng, bó bột khi gãy xương. Chọn đáp án D.
Câu 4: 2KCl + 2H2O 2KOH + Cl2 + H2. Chọn đáp án B.
Câu 5: Phát biểu đúng là: Trong hợp chất, tất cả các kim loại kiềm đều có số oxi hóa +1. Chọn đáp án A.
Câu 6:
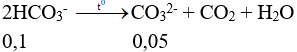
Có 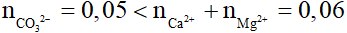
2. Phần tự luận
Câu 1 (2 điểm): NaCl → NaOH → NaHCO3 → Na2CO3 → NaCl.
HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PTHH.
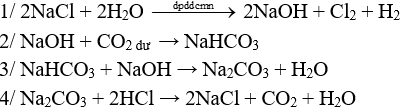
Câu 2 (3 điểm): Tính được số mol CO2 = 0,15 mol, số mol OH- = 0,35 mol
Đặt 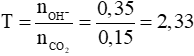
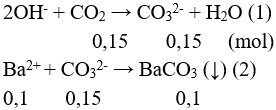
Từ phản ứng (2) → Ba2+ hết, m↓ = mBaCO3 = 0,1.197 = 19,7 gam.
Câu 3 (2 điểm): Tính được số mol khí = 0,15 mol
Đặt 2 kim loại A và B tương ứng với 1 KL là R.
Giả sử MA < MB → MA < MR < MB
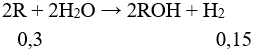
MR = 8,5 : 0,3 = 28,33. Vậy hai kim loại là Na và K.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 15 phút
(Đề 3)
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, C = 12, Na = 23, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Kim loại nào sau đây điều chế được bằng phương pháp thủy luyện?
A. Ca.
B. K.
C. Mg.
D. Cu.
Câu 2: Khi nói về kim loại kiềm, phát biểu nào sau đây là sai?
A. Các kim loại kiềm có màu trắng bạc và có ánh kim.
B. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
C. Từ Li đến Cs khả năng phản ứng với nước giảm dần
D. Kim loại kiềm có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 3: Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là
A. HCl, NaOH, Na2CO3.
B. NaOH, Na3PO4, Na2CO3.
C. KCl, Ca(OH)2, Na2CO3.
D. HCl, Ca(OH)2, Na2CO3.
Câu 4: Dung dịch chất X không làm đổi màu quỳ tím; dung dịch chất Y làm quỳ tím hóa xanh. Trộn lẫn hai dung dịch trên thu được kết tủa. Hai chất X và Y tương ứng là
A. KNO3 và Na2CO3.
B. Ba(NO3)2 và Na2CO3.
C. Na2SO4 và BaCl2.
D. Ba(NO3)2 và K2SO4.
Câu 5: Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch sau: HNO3, Na2SO4, Ba(OH)2, NaHSO4. Số trường hợp có phản ứng xảy ra là
A. 3.
B. 2.
C. 1.
D. 4.
Câu 6: Chất nào sau đây là thạch cao sống?
A. CaCO3.
B. CaO.
C. CaSO4. H2O.
D. CaSO4.2H2O.
II. Phần tự luận
Câu 1 (2 điểm): Viết các PTHH xảy ra trong sơ đồ sau:
NaCl → Na → NaOH → Na2CO3 → NaHCO3.
Câu 2 (3 điểm): Cho 6,8 gam hỗn hợp G gồm hai kim loại A và B liên tiếp trong nhóm IIA tác dụng với dung dịch H2SO4 loãng dư, sau phản ứng thu được 5,6 lít khí (ở đktc). Xác định thành phần % khối lượng của từng kim loại trong G.
Câu 3 (2 điểm): Hấp thụ hoàn toàn 0,672 lít khí CO2 (đktc) vào 1 lít dung dịch gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Tính giá trị của x.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đ/a | D | C | B | B | D | D |
Câu 1: Cu có thể được bằng phương pháp thủy luyện. Chọn đáp án D.
Câu 2: Phát biểu sai là: Từ Li đến Cs khả năng phản ứng với nước giảm dần. Chọn đáp án C.
Câu 3: Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là NaOH, Na3PO4, Na2CO3. Chọn đáp án B.
Câu 4: Dung dịch Ba(NO3)2 không làm đổi màu quỳ tím; dung dịch Na2CO3 làm quỳ tím hóa xanh.
Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3. Chọn đáp án B.
Câu 5: Ba(HCO3)2 tác dụng được với HNO3, Na2SO4, Ba(OH)2, NaHSO4. Chọn đáp án D.
Câu 6: Thạch cao sống: CaSO4.2H2O. Chọn đáp án D.
2. Phần tự luận
Câu 1 (2 điểm):
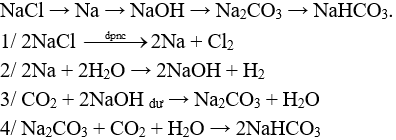
Câu 2 (3 điểm): Tính được nkhí = 0,25 mol
Đặt 2 kim loại tương ứng với một kim loại là R.
Giả sử MA < MB → MA < MR < MB
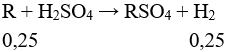
MR = 6,8 : 0,25 = 27,2. Vậy hai kim loại là Mg: a (mol) và Ca: b (mol).
mG = 6,8 gam → 24a + 40b = 6,8
nG = 0,25 mol → a + b = 0,25
Giải hệ được a = 0,2 và b = 0,05.
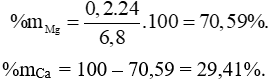
Câu 3 (2 điểm): Tính được số mol CO2 = 0,03 mol; số mol OH- = 0,05 mol
Đặt 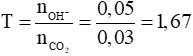
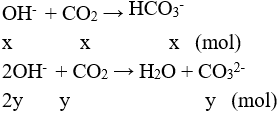
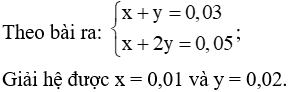
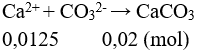
Vậy Ca2+ hết, m↓ = 0,0125.100 = 1,25 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Sở Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 15 phút
(Đề 4)
I. Phần trắc nghiệm
Câu 1: Nhận định nào sau đây là sai?
A. Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
B. Phương pháp nhiệt luyện dùng để điều chế các kim loại có độ hoạt động trung bình.
C. Na được điều chế bằng phương pháp điện phân nóng chảy.
D. Phương pháp điện phân nóng chảy dùng để điều chế các kim loại hoạt động trung bình hoặc yếu.
Câu 2: Kim loại không phản ứng với nước ở nhiệt độ thường là
A. Na.
B. Ba.
C. Be.
D. Ca.
Câu 3: Cho dãy các chất: FeCl2, CuSO4, BaCl2, KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 4: Công thức chung của oxit kim loại thuộc nhóm IA là
A. R2O3.
B. RO2.
C. R2O.
D. RO.
Câu 5: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng sau đó kết tủa tan dần.
Câu 6: Một mẫu nước cứng vĩnh cửu có chứa 0,03 mol Ca2+; 0,13 mol Mg2+; 0,12mol Cl- và a mol SO42-, giá trị của a là
A. 0,04 mol.
B. 0,05 mol.
C. 0,15 mol.
D. 0,10 mol.
II. Phần tự luận
Câu 1 (2 điểm): Viết các phương trình hóa học xảy ra trong các trường hợp sau:
a/ PbO tác dụng với H2.
b/ K tác dụng với H2O.
c/ Nhiệt phân KNO3.
d/ Nhiệt phân CaCO3.
Câu 2 (3 điểm): Cho 17 gam hỗn hợp X gồm hai kim loại kiềm A, B thuộc hai chu kỳ liên tiếp trong bảng tuần hoàn tác dụng với dd H2SO4 loãng, dư thu được 6,72 lít khí (ở đktc) và dung dịch Y. Xác định % khối lượng của các chất trong X.
Câu 3 (2 điểm): Dẫn V lít khí CO2 ở đktc vào 0,3 lít dd Ca(OH)2 0,02M thì thu được 0,2 gam kết tủa. Tính giá trị của V.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đ/a | D | C | A | C | C | D |
Câu 1: Phương pháp điện phân nóng chảy dùng để điều chế các kim loại hoạt động mạnh. Chọn đáp án D.
Câu 2: Be không tác dụng với nước ở điều kiện thường. Chọn đáp án C.
Câu 3: FeCl2, CuSO4 tác dụng được với NaOH. Chọn đáp án A.
Câu 4: Công thức chung của oxit kim loại thuộc nhóm IA là R2O. Chọn đáp án C.
Câu 5: Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 (↓trắng) + 2H2O. Chọn đáp án C.
Câu 6: Bảo toàn điện tích có: 0,03.2 + 0,13.2 = 0,12 + 2a → a = 0,1. Chọn đáp án D.
2. Phần tự luận
Câu 1 (2điểm): HS viết đúng mỗi PTHH 0,5 điểm, không cân bằng trừ ½ số điểm mỗi PTHH.
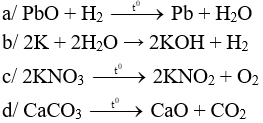
Câu 2 (3 điểm): Tính được số mol khí = 0,3 mol.
Đặt 2 kim loại A và B tương ứng với 1 kim loại là R.
Giả sử MA < MB → MA < MR < MB
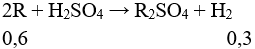
MR = 17 : 0,6 = 28,33. Vậy 2 kim loại là Na (x mol) và K ( y mol).
mR = 17g → 23x + 39y = 17
nR = 0,6 mol → x + y = 0,6
Giải hệ được x = 0,4 và y = 0,2
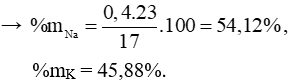
Câu 3 (2 điểm): Tính được số mol Ca(OH)2 = 0,006 mol, số mol kết tủa = 0,002 mol.
Có số mol Ca(OH)2 > số mol kết tủa. Xảy ra các TH sau:
Trường hợp 1: Ca(OH)2 dư
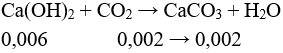
→ V = 0,002.22,4 = 0,0448 lít.
Trường hợp 2: Ca(OH)2 hết, sau pư thu được 2 muối.
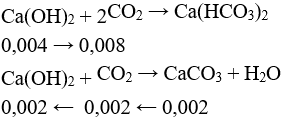
→ V = (0,008 + 0,002).22,4 = 0,224 lít.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Xem thêm các đề thi Hóa học 12 chọn lọc, có đáp án hay khác:
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 1)
- Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm có đáp án (Bài số 1)(8 đề)
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 2)
- Top 8 Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm có đáp án (Bài số 2)(8 đề)
- Đề kiểm tra 15 phút Hóa 12 Học kì 2 trắc nghiệm - tự luận có đáp án (Bài số 2)(3 đề)
- Top 9 Đề thi Hóa học 12 Giữa kì 2 năm 2026 (cấu trúc mới, có đáp án)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
- Top 9 Đề thi Hóa học 12 Giữa kì 2 năm 2026 (cấu trúc mới, có đáp án)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Giữa kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
- Top 9 Đề thi Hóa học 12 Học kì 2 năm 2026 (cấu trúc mới, có đáp án)
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm năm 2026 có đáp án (3 đề)
- Đề thi Hóa học 12 Học kì 2 trắc nghiệm - tự luận năm 2026 có đáp án (5 đề)
Để học tốt lớp 12 các môn học sách mới:
- Giải bài tập Lớp 12 Kết nối tri thức
- Giải bài tập Lớp 12 Chân trời sáng tạo
- Giải bài tập Lớp 12 Cánh diều
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 12 (các môn học)
- Giáo án điện tử lớp 12 (các môn học)
- Giáo án Toán 12
- Giáo án Ngữ văn 12
- Giáo án Vật Lí 12
- Giáo án Hóa học 12
- Giáo án Sinh học 12
- Giáo án Địa Lí 12
- Giáo án Lịch Sử 12
- Giáo án Lịch Sử 12 mới
- Giáo án GDCD 12
- Giáo án Kinh tế Pháp luật 12
- Giáo án Tin học 12
- Giáo án Công nghệ 12
- Giáo án GDQP 12
- Đề thi lớp 12 (các môn học)
- Đề thi Ngữ văn 12
- Đề thi Toán 12
- Đề thi Tiếng Anh 12 mới
- Đề thi Tiếng Anh 12
- Đề thi Vật Lí 12
- Đề thi Hóa học 12
- Đề thi Sinh học 12
- Đề thi Địa Lí 12
- Đề thi Lịch Sử 12
- Đề thi Giáo dục Kinh tế Pháp luật 12
- Đề thi Giáo dục quốc phòng 12
- Đề thi Tin học 12
- Đề thi Công nghệ 12




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

