500 bài tập trắc nghiệm Hóa học 9 (có lời giải)
Tổng hợp trên 500 bài tập trắc nghiệm môn Hóa học 9 chọn lọc, có lời giải chi tiết đầy đủ câu hỏi lý thuyết và các dạng bài tập từ cơ bản đến nâng cao, đầy đủ các mức độ giúp học sinh ôn luyện trắc nghiệm Hóa 9.
500 bài tập trắc nghiệm Hóa học 9 (có lời giải)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
- Trắc nghiệm Hóa học 9 Chân trời sáng tạo
- Trắc nghiệm Hóa học 9 Kết nối tri thức
- Trắc nghiệm Hóa học 9 Cánh diều
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Lưu trữ: Trắc nghiệm Hóa học 9 (sách cũ)
Các dạng bài tập Các loại hợp chất vô cơ
- Trắc nghiệm Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Bài tập trắc nghiệm Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Trắc nghiệm Một số oxit quan trọng
- Bài tập trắc nghiệm Một số oxit quan trọng
- Trắc nghiệm Tính chất hóa học của axit
- Bài tập trắc nghiệm Tính chất hóa học của axit
- Trắc nghiệm Một số axit quan trọng
- Bài tập trắc nghiệm Một số axit quan trọng
- Trắc nghiệm tổng hợp Tính chất hóa học của oxit và axit
- Bài tập trắc nghiệm Luyện tập: Tính chất hóa học của oxit và axit
- Trắc nghiệm Tính chất hóa học của bazơ
- Bài tập trắc nghiệm Tính chất hóa học của bazơ
- Trắc nghiệm Một số bazơ quan trọng
- Bài tập trắc nghiệm Một số bazơ quan trọng
- Trắc nghiệm Tính chất hóa học của muối
- Bài tập trắc nghiệm Tính chất hóa học của muối
- Trắc nghiệm Một số muối quan trọng
- Bài tập trắc nghiệm Một số muối quan trọng
- Trắc nghiệm Phân bón hóa học
- Bài tập trắc nghiệm Phân bón hóa học
- Trắc nghiệm Mối quan hệ giữa các loại hợp chất vô cơ
- Trắc nghiệm tổng hợp Các loại hợp chất vô cơ
Các dạng bài tập Kim loại
- Trắc nghiệm Tính chất vật lí của kim loại
- Bài tập trắc nghiệm Tính chất vật lí của kim loại
- Trắc nghiệm Tính chất hóa học của kim loại
- Bài tập trắc nghiệm Tính chất hóa học của kim loại
- Trắc nghiệm Dãy hoạt động hóa học của kim loại
- Bài tập trắc nghiệm Dãy hoạt động hóa học của kim loại
- Trắc nghiệm Nhôm
- Bài tập trắc nghiệm Nhôm
- Trắc nghiệm Sắt
- Bài tập trắc nghiệm Sắt
- Trắc nghiệm Hợp kim sắt: Gang, thép
- Bài tập trắc nghiệm Hợp kim sắt: Gang, thép
- Trắc nghiệm Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Bài tập trắc nghiệm Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Trắc nghiệm tổng hợp Kim loại
- Trắc nghiệm ôn tập Các loại hợp chất vô cơ; Kim loại
Các dạng bài tập Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Trắc nghiệm Tính chất của phi kim
- Bài tập trắc nghiệm Tính chất của phi kim
- Trắc nghiệm Clo
- Bài tập trắc nghiệm Clo
- Trắc nghiệm Cacbon
- Bài tập trắc nghiệm Cacbon
- Trắc nghiệm Các oxit của cacbon
- Bài tập trắc nghiệm Các oxit của cacbon
- Trắc nghiệm carbonic acid và muối carbonate
- Bài tập trắc nghiệm carbonic acid và muối carbonate
- Trắc nghiệm Silic. Công nghiệp silicat
- Bài tập trắc nghiệm Silic. Công nghiệp silicat
- Trắc nghiệm Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Bài tập trắc nghiệm Sơ lược về bảng tuần hoàn các nguyên tố hóa học
- Trắc nghiệm tổng hợp Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Các dạng bài tập hydrocarbon. Nhiên liệu
- Trắc nghiệm Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Bài tập trắc nghiệm Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
- Trắc nghiệm Cấu tạo phân tử hợp chất hữu cơ
- Bài tập trắc nghiệm Cấu tạo phân tử hợp chất hữu cơ
- Trắc nghiệm methane
- Bài tập trắc nghiệm methane
- Trắc nghiệm Etilen
- Bài tập trắc nghiệm Etilen
- Trắc nghiệm Acetylene
- Bài tập trắc nghiệm acetylene
- Trắc nghiệm benzene
- Bài tập trắc nghiệm benzene
- Trắc nghiệm Dầu mỏ và khí thiên nhiên
- Bài tập trắc nghiệm Dầu mỏ và khí thiên nhiên
- Trắc nghiệm Nhiên liệu
- Bài tập trắc nghiệm Nhiên liệu
- Trắc nghiệm tổng hợp hydrocarbon - Nhiên liệu
Các dạng bài tập Dẫn xuất của hydrocarbon. polymer
- Trắc nghiệm ethylic alcohol
- Bài tập trắc nghiệm ethylic alcohol
- Trắc nghiệm acetic acid
- Bài tập trắc nghiệm acetic acid
- Trắc nghiệm Mối liên hệ giữa etilen, ethylic alcohol và acetic acid
- Bài tập trắc nghiệm Mối liên hệ giữa etilen, ethylic alcohol và acetic acid
- Trắc nghiệm Chất béo
- Bài tập trắc nghiệm Chất béo
- Trắc nghiệm tổng hợp ethylic alcohol, acetic acid và chất béo
- Trắc nghiệm glucose
- Bài tập trắc nghiệm glucose
- Trắc nghiệm saccharose
- Bài tập trắc nghiệm saccharose
- Trắc nghiệm Tinh bột và Cellulose
- Bài tập trắc nghiệm Tinh bột và Cellulose
- Trắc nghiệm Protein
- Bài tập trắc nghiệm Protein
- Trắc nghiệm polymer
- Bài tập trắc nghiệm polymer
- Trắc nghiệm tổng hợp Ôn tập cuối năm Hóa học 9
Trắc nghiệm Tính chất hóa học của oxit
Câu 1: basic oxide không có tính chất hóa học nào sau đây?
A. Một số basic oxide tác dụng được với nước ở điều kiện thường.
B. basic oxide tác dụng được với dung dịch axit.
C. basic oxide tác dụng được với tất cả kim loại.
D. Một số basic oxide tác dụng được với acidic oxide.
Lời giải:
basic oxide không có tính chất tác dụng được với tất cả kim loại.
Đáp án: C
Câu 2: Dãy các chất tác dụng được với basic oxide Na2O là:
A. H2O, SO2, HCl
B. H2O, CO, HCl
C. H2O, NO, H2SO4
D. H2O, CO, H2SO4
Lời giải:
A. tác dụng với Na2O
B. có CO không tác dụng
C. có NO không tác dụng
D. có CO không tác dụng
Đáp án: A
Câu 3: Tính chất hóa học của acidic oxide là
A. tác dụng với nước.
B. tác dụng với dung dịch bazơ.
C. tác dụng với một số basic oxide.
D. cả 3 đáp án trên.
Lời giải:
Tính chất hóa học của acidic oxide là
- Tác dụng với nước.
- Tác dụng với dung dịch bazơ.
- Tác dụng với một số basic oxide.
Đáp án: D
Câu 4: acidic oxide có thể tác dụng được với
A. basic oxide
B. nước
C. bazơ
D. cả 3 hợp chất trên
Lời giải:
Tính chất hóa học của acidic oxide là
+ Tác dụng với nước tạo thành dung dịch axit
+ Tác dụng với dung dịch bazơ tạo thành muối và nước
+ Tác dụng với một số basic oxide tạo thành muối
Đáp án: D
Câu 5: Cho các basic oxide sau: Na2O, FeO, CuO, Fe2O3, BaO. Số basic oxide tác dụng với nước ở nhiệt độ thường là
A. 2
B. 3
C. 4
D. 5
Lời giải:
Các basic oxide tác dụng được với nước ở nhiệt độ thường là: Na2O và BaO
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Đáp án: A
Câu 6: Oxit nào sau đây phản ứng với nước ở điều kiện thường?
A. Al2O3.
B. CuO.
C. Na2O.
D. MgO.
Lời giải:
Các basic oxide của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường.
Na2O + H2O → 2NaOH
Đáp án: C
Câu 7: Trong những dãy oxit sau, dãy gồm những chất tác dụng được với nước để tạo ra dung dịch kiềm là:
A. CuO, CaO, Na2O, K2O.
B. CaO, Na2O, K2O, BaO.
C. CuO, Na2O, BaO, Fe2O3.
D. PbO, ZnO, MgO, Fe2O3.
Lời giải:
Ghi nhớ: các oxit của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường tạo ra dung dịch bazo
A. loại CuO
B. thỏa mãn
C. loại CuO ; Fe2O3.
D. loại tất cả
Đáp án : B
Câu 8: Dãy các chất nào tác dụng được với nước?
A. SO2, CO2, Na2O, CaO
B. NO,CO, Na2O, CaO
C. SO2, CO2, FeO, CaO
D. NO, CO, Na2O, FeO
Lời giải:
A đúng
B sai do NO,CO là không tác dụng với nước
C sai do FeO không tác dụng với nước
D sai do NO, CO, FeO không tác dụng với nước
Đáp án: A
Câu 9: Khí carbon monoxide (CO) có lẫn tạp chất là khí carbon dioxide (CO2) và sulfur dioxide (SO2). Dùng dung dịch nào sau đây để tách được những tạp chất ra khỏi CO?
A. Dung dịch HCl.
B. Dung dịch Ca(OH)2.
C. Dung dịch H2SO4.
D. Dung dịch NaCl.
Lời giải:
Dẫn hỗn hợp khí qua dung dịch bazơ dư, các tạp chất là acidic oxide bị giữ lại. Khí đi ra khỏi dung dịch là CO (oxit trung tính không tác dụng với bazơ)
PTHH: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Đáp án: B
Câu 10: Cho 15,3 gam oxit của kim loại hóa trị II vào nước thu được 200 gam dung dịch bazơ với nồng độ 8,55%. Công thức của oxit trên là
A. Na2O.
B. CaO.
C. BaO.
D. K2O.
Lời giải:
Đặt công thức hóa học của oxit là MO
PTHH: MO + H2O → M(OH)2
Ta có:
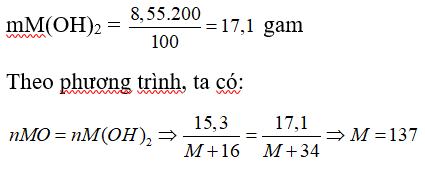
⇒ kim loại M là Ba
⇒ công thức oxit là BaO
Đáp án: C
Câu 11: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là
A. 1,50M.
B. 1,25M.
C. 1,35M.
D. 1,20M.
Lời giải:
nMgO = 0,25 mol
MgO + 2HCl → MgCl2 + H2O
0,25 → 0,5 mol
⇒ Nồng độ của dung dịch HCl là
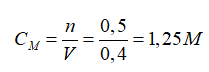
Đáp án: B
Câu 12: 0,05 mol FeO tác dụng vừa đủ với:
A. 0,02mol HCl.
B. 0,1mol HCl.
C. 0,05mol HCl.
D. 0,01mol HCl.
Lời giải:
FeO + 2HCl → FeCl2 + H2O
nFeO = 0,05 mol
theo phương trình nHCl = 2 nFeO = 0,1 mol
Đáp án: B
Câu 13: Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong 200 ml dung dịch H2SO4 0,45M loãng thì phản ứng vừa đủ, thu được dung dịch
B. Phần trăm khối lượng của MgO trong A là
A. 59,02%.
B. 61,34%.
C. 40,98%.
D. 38,66%.
Lời giải:
Gọi số mol của MgO và FeO trong hỗn hợp A là x và y mol
Vì mA = mMgO + mFeO = 40x + 72y
→ 40x + 72y = 4,88 (1)
Phương trình hóa học
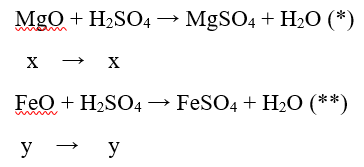
Theo phương trình (*):
nH2SO4 = 0,2.0,45 = 0,09 mol
→ x + y = 0,09 (2)
Từ (1) và (2) ta có hệ phương trình:
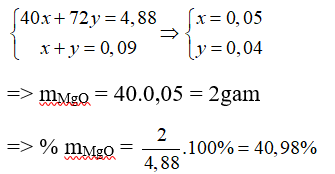
Đáp án: C
Câu 14: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là:
A. 46,5% và 53,5%
B. 53,5% và 46,5%
C. 23,25% và 76,75%
D. 76,75% và 23,25%
Lời giải:
PTPƯ: Na2O + SO2 → Na2SO3
nNa2O = nSO2 = 3,36:22,4 = 0,15(mol)
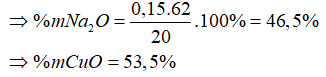
Đáp án: A
Câu 15: Hòa tan hoàn toàn 53,6 gam hỗn hợp A gồm (FeO, CuO) cần dùng vừa đủ 500 ml dung dịch H2SO4 1,4M (D = 1,2g/ml) thu được dung dịch X. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của muối FeSO4 trong dung dịch X là
A. 7,04%.
B. 6,06%.
C. 9,30%.
D. 6,98%.
Lời giải:
Gọi số mol của FeO và CuO lần lượt là x và y mol
⇒ mhỗn hợp = mFeO + mCuO ⇒ 72x + 80y = 53,6 (1)
nH2SO4 = 0,5.1,4 = 0,7 mol
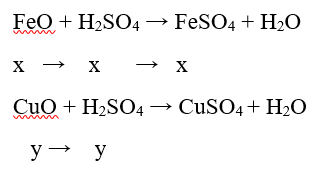
⇒ nH2SO4 = x + y = 0,7 (2)
Từ (1) và (2) ⇒ x = 0,3 mol; y = 0,4 mol
Ta có: m dung dịch H2SO4 = D.V = 1,2.500 = 600 gam
⇒ mdd trước phản ứng = mhỗn hợp A + mdd H2SO4 = 53,6 + 600 = 653,6 gam
Vì phản ứng không tạo chất khí hay chất kết tủa
⇒ mdd sau phản ứng = mdd trước phản ứng = 653,6 gam
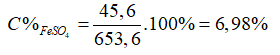
Đáp án: D
Trắc nghiệm Một số oxit quan trọng
Câu 1: Khi cho CaO vào nước thu được
A. dung dịch CaO.
B. dung dịch Ca(OH)2.
C. chất không tan Ca(OH)2.
D. cả B và C.
Lời giải:
Khi cho CaO vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2
Vì Ca(OH)2 là chất ít tan trong nước, phần tan tạo thành dung dịch bazơ và còn 1 phần không tan lắng xuống
Đáp án: D
Câu 2: Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Lời giải:
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
=> Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Đáp án: A
Câu 3: Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
A. CaCO3.
B. MgCO3.
C. NaCl.
D. CaO.
Lời giải:
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Đáp án: D
Câu 4: Canxi oxit có thể tác dụng được với những chất nào sau đây?
A. H2O, CO2, HCl, H2SO4.
B. CO2, HCl, NaOH, H2O.
C. Mg, H2O, NaCl, NaOH.
D. CO2, HCl, NaCl, H2O.
Lời giải:
Canxi oxit có thể tác dụng được với : H2O, CO2, HCl, H2SO4.
Đáp án: A
Câu 5: Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3.
B. BaO, K2O, SO2.
C. Al2O3, NO, SO2.
D. CaO, FeO, NO2.
Lời giải:
Các oxit tác dụng được với nước là BaO, K2O, SO2.
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
SO2 + H2O ⇆ H2SO3
Đáp án: B
Câu 6: Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng:
A. nước và quỳ tím.
B. dung dịch NaCl.
C. dung dịch KOH.
D. quỳ tím khô.
Lời giải:
Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng: nước và quỳ tím
- Cho 2 chất rắn vào nước => 2 chất rắn tan hết, tạo thành dung dịch
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Cho quỳ tím vào 2 dung dịch thu được
+ dung dịch làm quỳ chuyển xanh là Ca(OH)2 => chất rắn ban đầu là CaO
+ dung dịch làm quỳ chuyển đỏ là H3PO4 => chất rắn ban đầu là P2O5
Đáp án: A
Câu 7: BaO tác dụng được với các chất nào sau đây?
A. H2O, NO, KOH.
B. NaOH, SO3, HCl.
C. P2O5, CuO, CO.
D. H2O, H2CO3, CO2.
Lời giải:
BaO tác dụng được với: H2O, H2CO3, CO2.
BaO + H2O → Ba(OH)2
BaO + H2CO3 → BaCO3 + H2O
BaO + CO2 → BaCO3
Loại A vì BaO không phản ứng với KOH
Loại B vì BaO không phản ứng với NaOH
Loại C vì BaO không phản ứng với CO.
Đáp án: D
Câu 8: sulfur trioxide (SO3) tác dụng được với:
A. Nước, sản phẩm là bazơ.
B. Axit, sản phẩm là bazơ.
C. Nước, sản phẩm là axit.
D. Bazơ, sản phẩm là axit.
Lời giải:
SO3 là acidic oxide
=> tác dụng với nước cho sản phẩm là axit và tác dụng với bazo cho sản phẩm là muối
Đáp án: C
Câu 9: Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống (CaO), nếu hiệu suất là 85%?
A. 308,8 kg.
B. 388,8 kg.
C. 380,8 kg.
D. 448,0 kg.
Lời giải:
1 tấn đá vôi chứa 80% CaCO3 => mCaCO3 = 0,8 tấn = 800 kg
CaCO3 → CaO + CO2
100 kg → 56 kg
800 kg → 448 kg
Vì hiệu suất là 85% => mCaO thực tế = 448.85% = 380,8 kg
Đáp án: C
Câu 10: Từ 10 kg đá vôi ( không lẫn tạp chất) điều chế được bao nhiêu kg vôi sống, biết rằng hiệu suất toàn bộ quá trình là 75%?
Lời giải:
CaCO3 → CaO + CO2↑
Theo phương trình 100(g)→ 56 (g)
Hay 100 kg → 56 (kg)
Theo đề bài 10 kg → x (kg)
=> x = 10.56/100 = 5,6 (kg)
Vì H= 75% => lượng CaO thực tế thu được là: mCaO = 5,6. 75% : 100% = 4,2 (kg)
Đáp án: C
Câu 11: Hòa tan 0,56 gam CaO vào 800 ml nước thu được dung dịch nước vôi trong có nồng độ mol là
A. 0,15M.
B. 0,0125M.
C. 0,015M.
D. 0,0025M.
Lời giải:
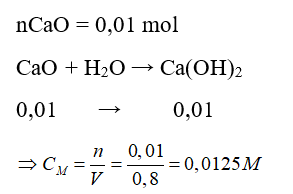
Đáp án: B
Câu 12: Để nhận biết hai khí SO2 và O2 ta dùng
A. quỳ tím ẩm.
B. dung dịch Ca(OH)2.
C. dung dịch Ba(OH)2.
D. cả A, B, C đều đúng.
Lời giải:
Để nhận biết hai khí SO2 và O2 ta có thể dùng:
- Qùy tím ẩm: SO2 làm quỳ chuyển đỏ, O2 không đổi màu
- Dung dịch Ca(OH)2 hoặc Ba(OH)2: SO2 làm dung dịch xuất hiện vẩn đục, O2 không hiện tượng
Đáp án: D
Câu 13: Khí X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục. Hỏi khí X là khí nào?
A. CO2
B. SO2
C. H2
D. H2S
Lời giải:
X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục → X là SO2 vì
SO2 + Ca(OH)2 → CaSO3 + H2O
Đáp án: B
Câu 14: Cho 8 gam sulfur trioxide (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là
A. 0,1M.
B. 0,4M.
C. 0,5M.
D. 0,6M.
Lời giải:
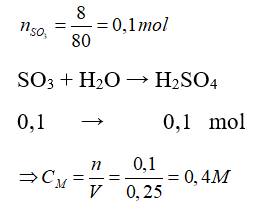
Đáp án: B
Câu 15: Hòa tan hết m gam SO3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam SO3 là:
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải:
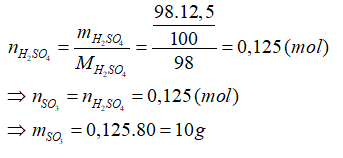
Đáp án: D
Xem thêm đề thi lớp 9 các môn học có đáp án hay khác:
Tài liệu giáo án lớp 9 các môn học chuẩn khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

