Bài tập lý thuyết về oxi, không khí, sự cháy (cực hay, chi tiết)
Bài viết lý thuyết về oxi, không khí, sự cháy với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập về oxi, không khí, sự cháy.
Bài tập lý thuyết về oxi, không khí, sự cháy (cực hay, chi tiết)
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
A. Lý thuyết & Phương pháp giải
Một số lý thuyết cần nắm vững để làm được các bài tập lý thuyết về oxi - không khí - sự cháy:
I. Oxi
- Kí hiệu hóa học của nguyên tố oxi là O.
- Công thức hóa học của đơn chất oxi là O2.
- Nguyên tử khối 16 amu, phân tử khối 32 amu.
1. Tính chất vật lí
- Là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí
- Oxi hóa lỏng ở -183°C
- Oxi lỏng có màu xanh nhạt
2. Tính chất hóa học: Oxi có thể tác dụng với kim loại, phi kim và các hợp chất ở nhiệt độ cao. Trong các hợp chất hóa học oxi hóa trị II.
- Tác dụng với phi kim: S + O2 
4P + 5O2 (dư) 
- Tác dụng với kim loại: 3Fe + 2O2 
- Tác dụng với hợp chất: CH4 + 2O2 
3. Điều chế
Trong phòng thí nghiệm, O2 được điều chế bằng phản ứng phân hủy những hợp chất giàu oxi và không bền với nhiệt như KMnO4, KClO3, H2O2…
Ví dụ: 2KMnO4 
II. Không khí
1. Thành phần chính
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cụ thể oxi chiếm 21% thể tích, phần còn lại hầu hết là nitơ
2. Thành phần khác
Các khí khác (hơi nước, CO2, khí hiếm, bụi khói,…) chiếm tỉ lệ rất nhỏ, chỉ khoảng 1%.
3. Bảo vệ không khí trong lành, tránh ô nhiễm
- Không khí bị ô nhiễm gây tác hại đến sức khỏe con người, đời sống động vật, thực vật, phá hoại dần những công trình xây dựng…
- Một số biện pháp bảo vệ không khí trong lành:
+ Xử lí khí thải của các nhà máy, lò đốt … hạn chế đến mức thấp nhất việc đưa vào khí quyển các khí có hại như CO2, SO2, bụi…
- Bảo vệ rừng, trồng rừng, trồng nhiều cây xanh…
III. Sự cháy
1. Sự cháy
- Là sự oxi hóa có tỏa nhiệt và phát sáng.
- Sự khác nhau giữa sự cháy trong oxi và trong không khí: cháy trong không khí diễn ra chậm hơn, tạo nhiệt độ thấp hơn trong oxi. Do trong không khí còn có nitơ với thể tích gấp 4 lần oxi, làm diện tích tiếp xúc của vật với oxi ít nên sự cháy diễn ra chậm hơn. Đồng thời, nhiệt tiêu hao còn dùng để đốt nóng khí nitơ nên nhiệt độ đạt được thấp hơn.
2. Sự oxi hóa chậm
- Là sự oxi hóa có tỏa nhiệt nhưng không phát sáng.
Ví dụ: sắt để lâu trong không khí bị gỉ.
- Trong điều kiện nhất định, sự oxi hóa chậm có thể chuyển thành sự cháy (gọi là sự tự bốc cháy)
Ví dụ: Giẻ lau máy có dính dầu mỡ nếu chất thành đống có thể xảy ra sự tự bốc cháy.
3. Điều kiện phát sinh và các biện pháp dập tắt sự cháy
- Điều kiện phát sinh sự cháy:
+ Chất phải nóng đến nhiệt độ cháy.
+ Có đủ oxi cho sự cháy.
- Cách dập tắt sự cháy:
Thực hiện một hay đồng thời cả hai biện pháp sau:
+ Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
+ Cách li chất cháy với oxi.
B. Ví dụ minh họa
Ví dụ 1: Nêu hiện tượng của phản ứng khi đốt cháy lưu huỳnh trong không khí và trong khí oxi?
Lời giải:
- Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi mãnh liệt hơn, tạo thành khí sulfur dioxide SO2 (còn gọi là khí sunfurơ).
- Phương trình hóa học: S + O2 
Ví dụ 2: Đốt cháy hết 3,1 gam photpho trong bình chứa oxi tạo ra diphosphorus pentoxide. Tính khối lượng oxit thu được sau phản ứng?
Lời giải:
nP = 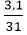
4P + 5O2 
0,1 → 0,05 (mol)
mP205 = 0,05.142 = 7,1 gam.
Ví dụ 3: Tính thể tích khí oxi (đktc) phản ứng khi đốt cháy hết 3,6 g C ?
Lời giải:
nC = 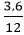
C + O2 
0,3 → 0,3 (mol)
Vậy VO2 = 0,3.22,4 = 6,72 lít
C. Bài tập vận dụng
Câu 1: Khí oxi nặng hơn không khí bao nhiêu lần?
A. 1,1 lần.
B. 0,55 lần.
C. 0,90625 lần.
D. 1,8125 lần.
Lời giải:
Đáp án A.
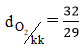
Câu 2: Cháy mạnh trong oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành lọ dưới dạng bột hòa tan được nước là hiện tượng của phản ứng nào sau đây?
A. 4P + 5O2 
B. C + O2 
C. S + O2 
D. 2Zn + O2 
Lời giải:
Đáp án A.
Phương trình hóa học: 4P + 5O2 
Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là diphosphorus pentoxide có công thức hóa học là P2O5.
Câu 3: Tính chất nào sau đây mà oxi không có:
A. Oxi là chất khí.
B. Trong các hợp chất, oxi có hóa trị II.
C. Tan nhiều trong nước.
D. Nặng hơn không khí.
Lời giải:
Đáp án C.
Oxi là khí không màu, không mùi, ít tan trong nước.
Câu 4: Chọn đáp án đúng:
A. Oxi không có khả năng kết hợp với chất hemoglobin trong máu.
B. Khí oxi là một đơn chất kim loại rất hoạt động.
C. Oxi nặng hơn không khí.
D. Oxi có 3 hóa trị.
Lời giải:
Đáp án C.
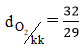
Câu 5: Trong không khí oxi chiếm bao nhiêu phần trăm thể tích?
A. 21%
B. 79%
C. 12%
D. 15%
Lời giải:
Đáp án A.
Thành phần của không khí: 21% khí oxi, 78% khí nitơ và 1% các khí khác.
Câu 6: Phương pháp nào để dập tắt đám cháy nhỏ do xăng dầu?
A. Quạt.
B. Phủ chăn bông hoặc vải dày.
C. Dùng nước.
D. Dùng cồn.
Lời giải:
Đáp án B.
Việc phủ chăn bông hoặc vải dày sẽ làm cách li chất cháy với oxi, khi đó sẽ không còn đủ oxi để duy trì sự cháy.
Không dùng quạt, nước hay cồn do sẽ làm đám cháy lan rộng hoặc cháy mãnh liệt hơn.
Câu 7: Chọn đáp án đúng nhất. Bản chất của phản ứng cháy là
A. Cần có oxi.
B. Sản phẩm tạo ra có CO2.
C. Là phản ứng oxi hóa – khử.
D. Là phản ứng tỏa nhiệt.
Lời giải:
Đáp án C.
Bản chất của phản ứng cháy là phản ứng oxi hóa – khử.
Câu 8: Để bảo vệ không khí trong lành chúng ta nên làm gì?
A. Chặt cây xây cầu cao tốc.
B. Đổ chất thải chưa qua xử lí ra môi trường.
C. Trồng cây xanh.
D. Xây thêm nhiều khu công nghiệp.
Lời giải:
Đáp án C.
Để bảo vệ không khí trong lành, tránh ô nhiễm chúng ta nên:
- Xử lí chất thải trước khi thải ra môi trường.
- Bảo vệ rừng, trồng cây xanh.
Câu 9: Điều kiện phát sinh phản ứng cháy là:
A. Chất phải nóng đến nhiệt độ cháy.
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy.
D. Cả A và B.
Lời giải:
Đáp án D.
Điều kiện phát sinh:
- Chất phải nóng đến nhiệt độ cháy
- Có đủ oxi cho sự cháy.
Câu 10: Sự giống nhau giữa sự cháy và sự oxi hóa chậm là:
A. Phát sáng.
B. Cháy.
C. Tỏa nhiệt.
D. Sự oxi hóa xảy ra chậm.
Lời giải:
Đáp án C.
Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng.
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng.
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
Xem thêm các dạng bài tập Hóa học lớp 8 có đáp án hay khác:
- Cách giải bài tập oxi tác dụng với kim loại (cực hay, có đáp án)
- Cách giải bài tập oxi tác dụng với phi kim (cực hay, có đáp án)
- Cách giải bài tập oxi tác dụng với hợp chất (cực hay, có đáp án)
- Cách giải bài tập về phản ứng hóa hợp (cực hay, có đáp án)
- Cách giải bài tập về oxit, phân loại oxit (cực hay, có đáp án)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Lý thuyết - Bài tập Hóa học lớp 8 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

