Bài tập về điều chế oxi (cực hay, có đáp án)
Bài viết điều chế oxi với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập điều chế oxi.
Bài tập về điều chế oxi (cực hay, có đáp án)
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
A. Lý thuyết & Phương pháp giải
Cần nắm vững các kiến thức sau:
I. Điều chế Oxi (O2) trong phòng thí nghiệm
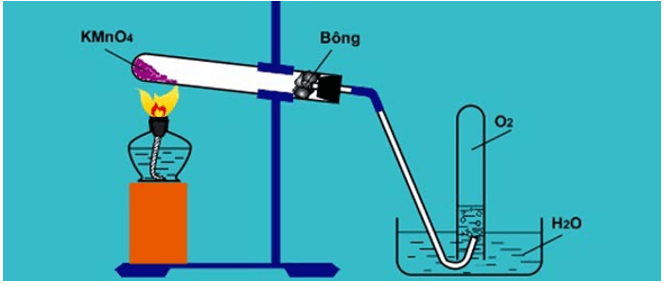
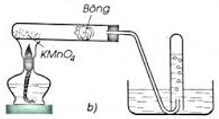
- Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3…
+ Điều chế Oxi từ nguyên liệu là kali permangante KMnO4
2KMnO4 
Hình minh họa điều chế O2 trong phòng thí nghiệm từ KMnO4.
+ Điều chế Oxi bằng từ nguyên liệu là kali clorat KClO3
2KClO3 
Thông thường nếu điều chế O2 từ KClO3 có dùng thêm chất xúc tác là MnO2. Do đó phản ứng hóa học có thể viết:
2KClO3 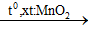
* Cách thu khí oxi:
Do oxi nặng hơn không khí và ít tan trong nước nên có thể thu khí oxi vào ống nghiệm hay lọ bằng hai cách:
a) đẩy không khí.
b) đẩy nước.
II. Sản xuất Oxi (O2) trong công nghiệp
Nguyên liệu để sản xuất khí oxi trong công nghiệp là không khí hoặc nước.
1. Sản xuất khí oxi từ không khí.
- Trước hết hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lòng bay hơi, đầu tiên thu được khí N2 (-196oC) sau đó là khí Oxi (-183oC).
2. Sản xuất khí oxi từ nước.
- Điện phân nước trong các bình điện phân, thu được 2 chất khí riêng biệt là Oxi và Hiđro
2H2O 
- Khí Oxi dùng trong công nghiệp thường được hoá lỏng và được nén dưới áp suất cao trong các bình thép.
B. Ví dụ minh họa
Ví dụ 1: Nhiệt phân hoàn toàn 24,5 gam KClO3 sau phản ứng thấy thoát ra V lít khí oxi (đktc). Tính giá trị của V ?
Lời giải:
nKClO3 = 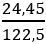
2KClO3 
0,2 → 0,3 (mol)
nO2 = 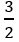
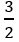
Vậy VO2 = 0,3.22,4 = 6,72 lít
Ví dụ 2: Khi nung nóng kali permangante (KMnO4) tạo thành Kali manganat (K2MnO4), mangan đioxit (MnO2) và khí oxi.
a. Hãy viết phương trình hóa học của phản ứng
b. Tính khối lượng kali permangante cần lấy để điều chế được 33,6 lít khí oxi (đktc).
Lời giải:
a. Phương trình hóa học:
2KMnO4 
b. nO2 = 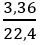
2KMnO4 
0,3 ← 0,15 (mol)
Theo phương trình: nKMnO4 = 2nO2 = 0,3 mol
mKMnO4 = 0,3.158 = 47,4 gam.
Ví dụ 3: Nếu lấy 2 chất kali permangante (KMnO4) và Kali clorat (KClO3) với khối lượng bằng nhau để điều chế oxi. Chất nào cho thể tích oxi nhiều hơn.
Lời giải:
MKClO3 = 122,5 g/mol ; MKMnO4 = 158 g/mol
Giả sử ta lấy cùng một khối lượng là a gam
nKClO3 = 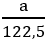
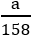
2KClO3 
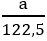

2KMnO4 
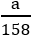
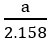
So sánh: 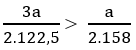
Vậy khi nhiệt phân cùng một lượng KClO3 sinh ra nhiều khí oxi hơn
C. Bài tập vận dụng
Câu 1: Người ta thu được khí oxi bằng cách đẩy nước nhờ vào tính chất nào?
A. Khí oxi tan trong nước.
B. Khí oxi ít tan trong nước.
C. Khí oxi khó hóa lỏng.
D. Khí oxi nhẹ hơn nước.
Lời giải:
Đáp án B
Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất: Khí oxi ít tan trong nước.
Câu 2: Người ta thu được khí oxi bằng cách đẩy không khí nhờ vào tính chất nào?
A. Khí oxi nhẹ hơn không khí.
B. Khí oxi nặng hơn không khí.
C. Khí oxi dễ trộn lẫn với không khí.
D. Khí oxi ít tan trong nước.
Lời giải:
Đáp án B
Người ta thu khí oxi bằng cách đẩy không khí nhờ dựa vào tính chất: khí oxi nặng hơn không khí
Câu 3: Nguyên liệu để sản xuất O2 trong công nghiệp là phương án nào sau đây?
A. KMnO4
B. KClO3
C. KNO3
D. Không khí
Lời giải:
Đáp án D
Nguyên liệu để sản xuất O2 trong công nghiệp là: không khí
Sản xuất khí oxi từ không khí bằng cách hạ không khí xuống dưới -200oC, sau đó nâng dần nhiệt độ lên -196oC ta thu được khí N2, sau đó nâng đến -183oC ta thu được khí oxi.
Câu 4: Các chất dùng để điều chế khí Oxi trong phòng thí nghiệm là:
A. KClO3
B. KMnO4
C. CaCO3
D. Cả A và B
Lời giải:
Đáp án D
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
Câu 5: Nhiệt phân 12,25 g KClO3 thu được khí oxi. Tính thể tích của khí thu được ở đktc là:
A. 4,8 lít
B. 3,36 lít
C. 2,24 lít
D. 3,2 lít
Lời giải:
Đáp án B
nKClO3 = 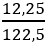
2KClO3 
0,1 → 0,15 (mol)
Vậy VO2 = 0,15.22,4 = 3,36 lít
Câu 6: Cho phản ứng 2KMnO4 
Tổng hệ số cân bằng của các chất sản phẩm là:
A. 3
B. 2
C. 1
D. 5
Lời giải:
Đáp án A
2KMnO4 
Tổng hệ số sản phẩm 1 + 1 + 1 = 3
Câu 7: Tính khối lượng KMnO4 để điều chế được 2,7552 lít khí oxi (đktc).
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Lời giải:
Đáp án B
nO2 = 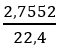
2KMnO4 
0,246 ← 0,123 (mol)
mKMnO4 = 0,246.158 = 38,868 gam.
Câu 8: Không dùng cách nào sau đây để điều chế oxi trong phòng thí nghiệm?
A. Đun nóng KMnO4.
B. Đung nóng KClO3 với xúc tác MnO2.
C. Phân hủy H2O2.
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án D
Chưng cất phân đoạn không khí lỏng dùng sản xuất O2 trong công nghiệp.
Câu 9: Nhiệt phân hoàn toàn 31,6 gam KMnO4, thu được V lít O2 (đktc). Giá trị của V là
A. 2,24 lít
B. 1,12 lít
C. 4,48 lít
D. 8,96 lít
Lời giải:
Đáp án A
nKMnO4 = 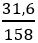
2KMnO4 
0,2 → 0,1 (mol)
⇒ VO2 = 0,1.22,4 = 2,24 (lít)
Câu 10: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. KMnO4.
B. NaHCO3.
C. (NH4)2SO4.
D. CaCO3.
Lời giải:
Đáp án A
Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
2KMnO4 
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
Xem thêm các dạng bài tập Hóa học lớp 8 có đáp án hay khác:
- Bài tập về phản ứng phân hủy (cực hay, có đáp án)
- Phân biệt sự cháy và sự oxi hóa chậm (cực hay, có đáp án)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Lý thuyết - Bài tập Hóa học lớp 8 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

