Cách giải bài tập về oxit, phân loại oxit (cực hay, có đáp án)
Bài viết Cách giải bài tập về oxit, phân loại oxit với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập về oxit, phân loại oxit.
Cách giải bài tập về oxit, phân loại oxit (cực hay, có đáp án)
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
A. Lý thuyết & Phương pháp giải
Cần nắm vững các kiến thức sau:
I. Định nghĩa
Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
Ví dụ: CuO, Na2O, FeO, SO2, CO2...
II. Công thức
Công thức chung:
Với:
- M là nguyên tố khác oxi, M có hóa trị n.
- x, y: chỉ số nguyên tử của mỗi nguyên tố.
Theo quy tắc hóa trị, ta có: n.x = II.y
III. Phân loại
Gồm 2 loại chính: acidic oxide và basic oxide.
1. Acidic oxide: Thường là oxit của phi kim và tương ứng với một axit.
- Ví dụ: CO2, SO2, SO3, P2O5, N2O5...
+ CO2 tương ứng với carbonic acid H2CO3;
+ SO2 tương ứng với sulfurous acid H2SO3;
+ P2O5 tương ứng với phosphoric acid H3PO4.
2. basic oxide: Là oxit của kim loại và tương ứng với một bazơ.
- Ví dụ: K2O, CuO, FeO...
+ K2O tương ứng với bazơ potassium hydroxide KOH.
+ CuO tương ứng với bazơ copper (II) hydroxide Cu(OH)2.
+ MgO tương ứng với bazơ magnesium hydroxide Mg(OH)2.
Chú ý:
- Một số kim loại nhiều hóa trị cũng tạo ra acidic oxide.
Ví dụ: manganese (VII) oxide Mn2O7 là acidic oxide, tương ứng với permanganic acid HMnO4.
- Ngoài hai loại oxit chính là acidic oxide và basic oxide còn có oxit lưỡng tính (ví dụ: Al2O3, ZnO…) và oxit trung tính (ví dụ: NO, CO…) (sẽ học ở lớp 9).
Phương pháp giải bài tập xác định công thức oxit dựa vào khối lượng mol phân tử hoặc phần trăm khối lượng:
Bước 1: Gọi công thức của oxit có dạng R2On
Bước 2: Dựa vào khối lượng mol phân tử hoặc phần trăm khối lượng => xác định mối liên hệ giữa R và n
Bước 3: Lập bảng xác định R dựa vào n, cho n từ 1, 2, 3, 4… Nếu đầu bài đã cho biết R hoặc n thì không cần lập bảng.
Bước 4: Chọn giá trị R phù hợp với n và kết luận nguyên tố R.
B. Ví dụ minh họa
Ví dụ 1: Trong các công thức hóa học sau: BaO, C2H6O, ZnO, SO3, KOH, CO2.
a) Công thức hóa học nào là công thức hóa học của oxit.
b) Phân loại các oxit đã xác định ở ý (a).
Lời giải:
a) Các công thức hóa học của oxit là: BaO, MgO, SO3, CO2.
b) acidic oxide: SO3, CO2.
basic oxide: BaO, MgO.
Ví dụ 2: Cho các oxit sau: SO2, CaO, Al2O3, P2O5.
a) Các oxit này có thể được tạo thành từ các đơn chất nào?
b) Viết phương trình phản ứng điều chế các oxit trên.
Lời giải:
a) SO2 tạo nên từ 2 đơn chất là S và O2.
CaO tạo nên từ 2 đơn chất là Ca và O2.
Al2O3 tạo nên từ 2 đơn chất là Al và O2.
P2O5 tạo nên từ 2 đơn chất là P và O2.
b) Phương trình phản ứng:
S + O2 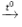
2Ca + O2 → 2CaO
4Al + 3O2 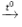
4P + 5O2 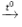
Ví dụ 3: Một hợp chất oxit chứa 50% về khối lượng của S. Xác định công thức hóa học của oxit.
Lời giải:
Gọi công thức oxit của S cần tìm là S2On
Nguyên tố S chiếm 50% về khối lượng :
=> %mS = 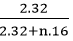
=> 2.32 = 0,5.(2.32 + 16n) => n = 4
=> Công thức chưa tối giản là S2O4 => công thức oxit là SO2.
C. Bài tập vận dụng
Câu 1: Trong các hợp chất sau, hợp chất nào thuộc loại oxit?
A. K2O.
B. H2S.
C. CuSO4.
D. Mg(OH)2.
Lời giải:
Đáp án A.
Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
Hợp chất thuộc loại oxit là: K2O
Câu 2: Oxit bắt buộc phải có nguyên tố nào?
A. Oxi .
B. Halogen.
C. Hiđro.
D. Lưu huỳnh.
Lời giải:
Đáp án A.
Oxit bắt buộc phải có nguyên tố oxi.
Vì theo định nghĩa: Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
Câu 3: ZnO thuộc loại oxit gì?
A. Acidic oxide.
B. basic oxide.
C. Oxit trung tính.
D. Oxit lưỡng tính.
Lời giải:
Đáp án D.
ZnO thuộc loại oxit lưỡng tính vì tạo bởi ZnO vừa tác dụng với axit vừa tác dụng với bazơ.
Câu 4: Hợp chất nào sau đây không phải là oxit?
A. CO2
B. SO2
C. CuO
D. CuS
Lời giải:
Đáp án D.
Hợp chất không phải là oxit là: CuS vì không có nguyên tử O.
Câu 5: Cho các công thức sau: CaO, CuO, NaO, CO2, CO3. Công thức oxit viết sai là:
A. CaO, CuO
B. NaO, CaO
C. NaO, CO3
D. CuO, CO3
Lời giải:
Đáp án C.
Ca có hóa trị II => hợp chất oxit của Ca là : CaO
Cu có hóa trị II => oxit của Cu là CuO
Na có hóa trị I => oxit của Na là Na2O
C có hóa trị II, IV => 2 oxit của C là CO và CO2
=> không có công thức oxit NaO và CO3.
Câu 6: Chỉ ra các basic oxide trong các oxit sau: P2O5, CaO, CuO, BaO, Na2O
A. P2O5, CaO, CuO
B. CaO, CuO, BaO, Na2O
C. BaO, Na2O, P2O3
D. P2O5, CaO, P2O3
Lời giải:
Đáp án B.
basic oxide là oxit của kim loại. Các kim loại là: Ca, Cu, Ba, Na…
=> các basic oxide là: CaO, CuO, BaO, Na2O
Câu 7: Chỉ ra các acidic oxide trong các oxit sau: P2O5, CaO, CuO, BaO, SO2, CO2.
A. P2O5, CaO, CuO, BaO
B. BaO, SO2, CO2
C. CaO, CuO, BaO
D. SO2, CO2, P2O5
Lời giải:
Đáp án D.
Acidic oxide thường là oxit của phi kim. Các phi kim là: P, S, C…
=> các acidic oxide là: SO2, CO2 , P2O5.
Câu 8: Axit tương ứng của acidic oxide SO2 là
A. H2SO3.
B. H2SO4.
C. HSO3.
D. SO3.2H2O.
Lời giải:
Đáp án A.
Axit tương ứng của acidic oxide SO2 là H2SO3.
Câu 9: Oxit của nguyên tố R có hóa trị III chứa 70% về khối lượng nguyên tố R. Xác định R và cho biết oxit trên thuộc loại acidic oxide hay basic oxide.
A. C, acidic oxide.
B. Fe, basic oxide.
C. Mg, basic oxide.
D. Fe, acidic oxide.
Lời giải:
Đáp án B.
Oxit của R có hóa trị III là R2O3
Nguyên tố R chiếm 70% về khối lượng
=> %mR = 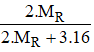
=> 2.MR = 0,7.(2.MR + 3.16) => MR = 56 (g/mol)
=> R là nguyên tố Fe.
Oxit Fe2O3 là basic oxide.
Câu 10: Công thức hóa học của một loại sắt oxit có tỉ lệ khối lượng như sau:
mFe : mO = 7 : 2. Xác định công thức hóa học của oxit?
A. FeO.
B. Fe2O3.
C. FeO2.
D. Fe2O4.
Lời giải:
Đáp án A.
Gọi công thức hóa học của oxit sắt cần tìm là Fe2On
Giả sử có 1 mol Fe2On
=> Khối lượng của Fe trong hợp chất là: 56.2 = 112 gam
Khối lượng của O trong hợp chất là: 16.n gam.
Ta có: mFe : mO = 7 : 2 hay 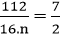
=> công thức chưa tối giản là: Fe2O2 => công thức oxit cần tìm là FeO.
D. Bài tập thêm
Câu 1: Một loại đồng oxide có thành phần về khối lượng các nguyên tố như sau: 8 phần là đồng và 1 phần là oxygen. Công thức đồng oxide trên là
A. Cu2O.
B. CuO.
C. Cu2O3.
D. CuO3.
Câu 2: Nhóm công thức biểu diễn toàn oxide là
A. CuO, HCl, SO3.
B. CO2, SO2, MgO.
C. FeO, KCl, P2O5.
D. N2O5, Al2O3, HNO3.
Câu 3: Oxide của một nguyên tố có hóa trị III, trong đó oxygen chiếm 30% về khối lượng. Công thức hóa học của oxide là
A. Fe2O3.
B. Al2O3.
C. Cr2O3.
D. N2O3.
Câu 4: Thiếc có thể có hóa trị II hoặc IV. Hợp chất có công thức SnO2 có tên là
A. tin dioxide.
B. tin oxide.
C. tin(II) oxide.
D. tin(IV) oxide.
Câu 5: Một loại oxide sắt trong đó cứ 14 phần sắt thì có 6 phần oxygen (về khối lượng). Công thức hóa học của oxide sắt là
A. FeO.
B. Fe2O3.
C. Fe3O4.
D. Không xác định.
Thi online KHTN 8 KNTTThi online KHTN 8 CDThi online KHTN 8 CTST
Xem thêm các dạng bài tập Hóa học lớp 8 có đáp án hay khác:
- Bài tập về cách gọi tên oxit (cực hay, có đáp án)
- Bài tập về điều chế oxi (cực hay, có đáp án)
- Bài tập về phản ứng phân hủy (cực hay, có đáp án)
- Phân biệt sự cháy và sự oxi hóa chậm (cực hay, có đáp án)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Lý thuyết - Bài tập Hóa học lớp 8 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 8.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

